Dendreon与Celldex在肿瘤疫苗之路上相继倒下,下一个幸运儿是谁?
| 导读 | 近日,从美国生物技术公司Celldex Therapeutics 传来了坏消息,其多型性神经胶母细胞瘤(GBMs)疫苗Rintega的关键III期临床试验因未能改善总生存期而宣告提前终止。 |

2016年3月7日早晨,从美国生物技术公司Celldex Therapeutics 传来了坏消息,其多型性神经胶母细胞瘤(GBMs)疫苗Rintega的关键III期临床试验因未能改善总生存期而宣告提前终止。(消息源于美中药源)

听到这一消息,宝宝的眼前一片黑,这个情景在2年前发生过同样一幕。对,那是2014年Dendreon公司的破产。这则噩耗让坚守在细胞治疗特别是DC肿瘤疫苗开发的科学家们怎么活啊?今天宝宝强忍住泪水为大家整理了这两个经典失败案例,希望对大家有借鉴之用。
Dendreon公司曾经是全美最风光生物技术上市公司,1992年,公司在华盛顿西雅图成立。2010年,全球第一支针对肿瘤免疫逃逸的治疗性疫苗产品Provenge获得FDA批准投放市场,赚足了医药界的眼球。整个项目耗时近20年。
但是在2014年11月份,Dendreon公司因负债高达6亿6千万美元而宣告破产,并最终以不到5亿美元的价格被Valeant公司收购。此时,距离公司的首个肿瘤免疫疗法获得FDA批准上市仅过了不到四年。尽管 2013 年 9 月 Provenge 获得欧盟批准,可以在 28 个成员国销售,但董事长 Mitchell Gold 退休、销售总监 Richard B. Brewer 去世、新任 CEO John Johnson 辞职,哪怕是奠出大幅裁员和削减成本两面大旗,仍然让公司无回天之力,公司股价也由巅峰时的57.67美元跌至13美分。
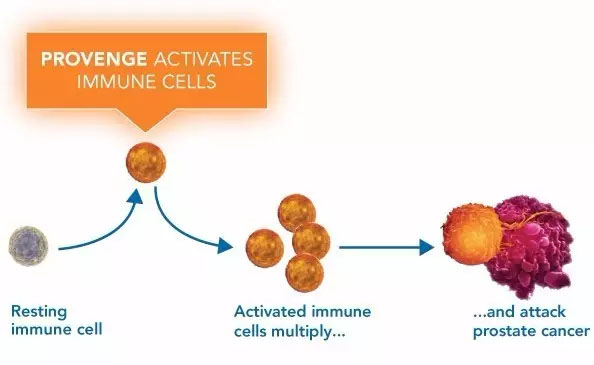
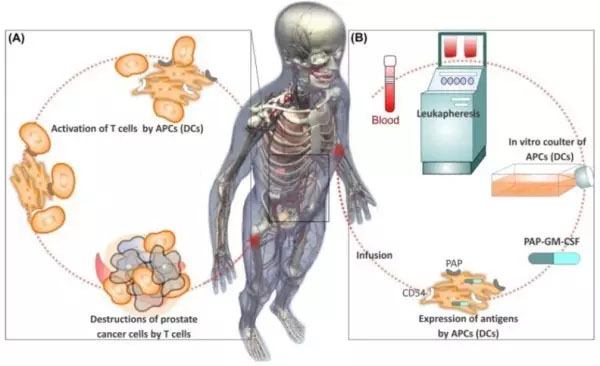
Provenge疫苗
是利用患者自身的免疫系统与恶性肿瘤抗争,它由载有重组前列腺酸性磷酸酶(PAP)抗原的肿瘤患者自身的神经元树突细胞(免疫系统抗原的递呈细胞)构成。PAP蛋白表达于绝大多数的前列腺肿瘤细胞,也表达于正常的前列腺组织中,只是以极低的水平存在于其他正常组织中。在治疗性肿瘤疫苗Provenge中,PAP抗原融合于作为佐剂的一种免疫刺激细胞因子—粒细胞一巨噬细胞集落刺激因子(GM.CSF),树突细胞则将PAP蛋白消化为多肽而呈现于其表面,当其被重新回输入患者体内后,可被免疫系统T细胞识别,而接触过该抗原后的T细胞能找到并杀灭表达PAP抗原的癌细胞。
前列腺癌是指发生在前列腺的上皮性恶性肿瘤。2004年WHO《泌尿系统及男性生殖器官肿瘤病理学和遗传学》中前列腺癌病理类型上包括腺癌(腺泡腺癌)、导管腺癌、尿路上皮癌、鳞状细胞癌、腺鳞癌。其中前列腺腺癌占95%以上,因此,通常我们所说的前列腺癌就是指前列腺腺癌。2012年我国肿瘤登记地区前列腺癌发病率为9.92/10万,列男性恶性肿瘤发病率的第6位。发病年龄在55岁前处于较低水平,55岁后逐渐升高,发病率随着年龄的增长而增长,高峰年龄是70~80岁。家族遗传型前列腺癌患者发病年龄稍早,年龄≤55岁的患者占43%。
前列腺癌的治疗,主要有手术治疗、激素治疗、化疗、放疗、免疫治疗等。具体选用何种方法,应根据患者年龄、全身状况、癌肿的局部范围以及转移情况而定。
(1)手术治疗:前列腺癌根治术,其范围包括前列腺腺体及前列腺的包膜;盆腔淋巴结清除术;经尿道前列腺切除,主要用于解除膀胱颈部梗阻。
(2)内分泌与肾上腺药物治疗:目前内分泌法已经是前列腺癌特别是晚期前列腺癌的主要治疗方法。1)雌激素类药物;2)抗雄激素药物,包括类固醇和非类固醇两类;3)促性腺释放激素类似物(GnRH-A);4)抗肾上腺药物。
(3)降低内分泌雄激素睾酮的手术治疗前列腺癌:1)睾丸切除术,常与其他治疗方法联合进行,可以取得较好的治疗效果;2)肾上腺切除术和垂体切除术,在临床上效果较差,对患者损伤较大,目前已不采用。
(4)化学治疗:前列腺癌的化学治疗于1973年用于临床,许多学者认为两种药物联合应用的效果较单独使用一种药物好。
(5)放射治疗:应用放射线治疗前列腺癌已有60余年的历史,主要有以下方法:1)体外放疗;2)组织内放疗,这种方式常与前列腺癌根治术或盆腔淋巴结清除术结合进行;3)全身放疗:在一定程度上可缓解骨转移的局部疼痛和减轻病变的发展。
(6)冷冻前列腺癌治疗:这种方法适用于前列腺肿瘤体积较大,全身情况较差的患者,可以促进患者的免疫能力,使骨、肺等转移病灶发生退化。由于需要特殊的设备,目前尚未广泛使用。
(7)免疫治疗:当患者的前列腺癌组织用其他治疗方法减到极微量时,应用免疫疗法清除体内残余的少量癌肿组织,可能会取得更好的效果。

Celldex Therapeutics公司是一家生物制药公司,专注于几种免疫治疗技术治疗癌症和其他难以治疗的疾病的开发和商业化。
该公司的领先候选药物包括Rindopepimut(CDX-110),在关键的第三期研究一线胶质母细胞瘤的治疗和第2阶段研究复发性胶质母细胞瘤和CDX-011,抗体药物的治疗有针对性的免疫治疗结合最近完成了一项随机2b期研究的晚期乳腺癌的治疗。该公司还有更多的临床方案,包括CDX-1135,一个分子抑制免疫系统,称为补体系统;CDX-1127,一种治疗人类抗体的癌症适应症;CDX-301,免疫细胞动员剂和树突的一部分细胞生长因子和CDX-1401,是癌症适应症的APC定位技术项目。
在Rindopepimut完成Ⅰ期临床研究报告中,研究人员对45位用药无效的晚期癌症病人进行疫苗注射治疗,探讨癌症疫苗的副作用及治疗剂量。结果发现,患者在所有的剂量水平下都对疫苗有良好的耐受性,唯一的副作用就是刺激性及在注射位点有发红现象。
在随后的中期临床试验显示,将 Rindopepimut疫苗添加到标准治疗中可使患有最致命形式的脑癌患者活得更久。这项试验的受度者为 73 名多形性成胶质细胞瘤 (GBM) 经治疗后又复发的患者,试验中有 30% 的以 Celldex 公司 Rintega 加罗氏阿瓦斯汀治疗患者在 18 个月后仍然存活,相比之下,仅接受阿瓦斯汀治疗的患者中只有 13% 的人存活。
2016年3月7号Celldex公司宣布Rintega作为初诊EGFRv3阳性的GBM患者的免疫治疗候选药第III期IVACT的临床试验失败提前结束。数据安全及监督委员会(Data.Safety.and.Monitoring.Board,
DSMB)认为,根据预期的中期临床试验结果分析来看,被初诊为EGFRv3阳性的GBM存活下来的病人,即使继续进行临床试验也将在总生存率上与对照组相比得不到受益结果,从而提前取消其第三期临床试验。
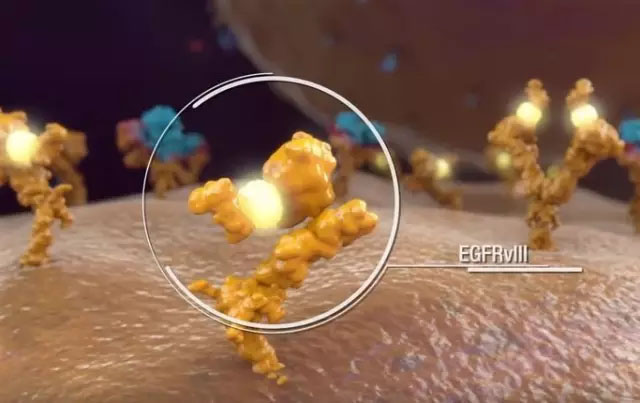
Rindopepimut 疫苗
是针对EGFR一种叫做EGFRvIII突变型的疫苗,由13个氨基酸接在一个叫做KLH的载体蛋白组成。2012年初Celldex医疗公司开始Rindopepimut结合阿伐斯汀治疗复发性表皮生长因子变异III型(EGFRvIII)成胶质细胞瘤的二阶段临床研究。该试验又叫做ReACT研究,将和Celldex三阶段试验(ACT IV)同时展开,目的是评估Rindopepimut用于新确诊的EGFRvIII表达成胶质细胞瘤(GB)效果。
多形性胶质母细胞瘤(GBM)为最常见且致死率极高的脑部肿瘤;其常渗入邻近组织,且形状多变而无确定范围。GBM是一种神经胶质瘤,是脑瘤中特别致命的一种。这种脑瘤具有高侵润性,可大范围转移,与健康脑组织混合在一起,使得通过外科手术除去肿瘤而不引起严重后果几乎是不可能的。而且,从研发肿瘤分离转移,形成卫星肿瘤的癌细胞能够逃过治疗,常常引起复发。
GBM的常规治疗包括手术、辐照和化学疗法,但是这些疗法仅具有微小改善的患者存活率。免疫治疗是最近几年的趋势。
两位巨人相继倒下,肿瘤疫苗的前景一片惨淡,到底我们设想的通过疫苗来治疗肿瘤的方式是否可取呢?科学家们几十年前就已经开始尝试开发肿瘤疫苗,但现实是残酷的:许多疫苗在动物实验阶段获得成功,最后却在大规模临床研究中以失败告终。很难说还在进行类似的临床研究不会重蹈覆辙,中国也有相当一部分的肿瘤疫苗出处于临床阶段,谁会成为第一个幸运儿,让我们一起翘首以盼。
我们在路上,已经没有机会返航…(来源:细胞培养俱乐部 2016-03-14 )
几种癌症疫苗
癌症一直以来都被称为“不治之症”,随着近些年来各国医疗水平的发展,在癌症治疗方面已经取得了长足的进步,让癌症患者的5年生存率得以大大的提高。然而,尽管如此,人们依然希望医疗技术可以将癌症“防范于未然”,就像当年的人类依靠疫苗接种消灭天花一样,能够研发出各类癌症疫苗,继而让人们体内拥有远离癌症的天然屏障。
人们的这一希望在2006年得以首次实现,当年世界上第一个癌症疫苗——宫颈癌疫苗获得美国食品药品管理局(FDA)的批准上市。宫颈癌疫苗的问世和普遍使用被看作是癌症防治进入新时代的标志,除此之外,关于其他癌症的疫苗研究也被各国科学家提上了研究日程表上——
前列腺癌疫苗
2010年4月29日,FDA批准了一种被称为Provenge的抗御前列腺癌的治疗性疫苗,通用名为Sipleucel-T,由丹德里昂公司(Dendreon)生产。该疫苗与传统意义上的疫苗不同,它属于一种新型的自体源性细胞免疫疗法疫苗(治疗性疫苗),适用于晚期前列腺癌患者,可以调动患者自身的免疫系统对抗疾病。
该疫苗对512名受试者进行的临床试验显示,采用Provenge治疗之后患者的总体生存期比对照组延长了4.1个月,前者平均存活时间为25.8个月,后者平均存活时间为21.7个月。3年之后,用Provenge治疗的患者有32%仍然存活,而对照组只有23%存活。不过,Provenge也有副作用,主要是发烧、发冷、疲劳和疼痛。
世界上已经存在多少癌症疫苗?
为满足FDA药品售后监测的要求,丹德里昂公司将继续招募1500名患者,展开4项临床试验,以进一步检测药物的安全性。
尽管该疫苗被证明对晚期前列腺癌有显着的疗效,但是目前研究人员还不能明确这种疫苗的具体作用机制。因为,Provenge疫苗是多种细胞相对粗糙的混合物,其中包括树突细胞用来激发免疫系统反应。纽约大学朗格尼医学中心的免疫学家尼娜·巴德瓦杰认为,如果能够确切地知道疫苗的工作原理和其他细胞做出的贡献,那才是完美的。
当然,由于Provenge疫苗研制的时间跨度达20年之久,疫苗的效果和安全性都比较理想。而许多第一代癌症疫苗,像胰腺癌疫苗PANVAC,虽然被认为是安全的,但是却不能证明对减缓癌症进程有显着效果。此外,这种治疗性疫苗需要为每个患者单独定制,估计费用比较高昂,每位患者可能要支付9.3万美元,疗法为一个月内注射3次。
黑色素瘤疫苗
皮肤黑色素瘤是一种致死性的癌症,继宫颈癌疫苗之后,恶性黑素瘤疫苗成为了癌症疫苗研究的热点之一。恶性黑色素瘤患者有时会出现自发性的病情缓解现象,恶性黑色素瘤偶尔也会自行消失,特别是在患者的免疫系统战胜了一次与恶性黑色素瘤完全没有关系的感染之后。这表明,不久之前被唤醒的免疫防御系统可以转向对付肿瘤。
美国伊利诺伊州拉什大学医学中心的研究表明,黑色素瘤疫苗有望进入临床治疗。该中心副主任霍华德·考夫曼领导的研究小组已完成了黑色素瘤疫苗的临床二期试验,已经进入临床三期试验。考夫曼研究团队使用的疫苗被称为OncoVEX,最初是用来治疗疱疹病毒的。研究人员意外地把这种疫苗放置于装有肿瘤细胞的皮氏培养皿时,发现该疫苗能附着在肿瘤组织上。这种疫苗含有溶瘤病毒,该病毒是重新编程的病毒,可以转化为依附在肿瘤细胞上的抗癌药剂,但对健康细胞不产生危害。OncoVEX疫苗也能作为一种生物制剂,促使机体免疫系统抗击黑色素瘤。他们对英国50名晚期转移性黑色素瘤患者进行的试验,获得了令人吃惊的结果。这50名患者都是用常规疗法治疗后无效的患者,包括化疗和免疫疗法,如使用白介素-2无效,这些患者预计还能生存9个月。在进行疫苗治疗后(每两周注射一次,共注射24次),8名患者完全康复,另有4人产生了部分疗效,总有效率为26%。而临床三期的研究将在全美国招募430名患者。
除了上述疫苗,其他一些研究人员用碾碎的恶性黑色素瘤细胞制成的疫苗,和用受到放射线辐射而致活性降低的恶性黑色素瘤细胞混合制成的疫苗也在试验中。
乳腺癌疫苗
2010年有两种乳腺癌疫苗值得关注:一种是抗御乳腺癌的DNA疫苗,另一种是α-乳清蛋白抗原疫苗。前者是由瑞典卡罗林斯卡医学院的研究人员研制的,后者是由美国俄亥俄州克利夫兰医院的研究人员发现的。
瑞典卡罗林斯卡医学院皮耶特拉斯等人发现,乳腺肿瘤含有带有大量的德尔塔样配体4蛋白(DLL4)。过去的研究发现,DLL4蛋白参与了新血管的生长和分支,通过抑制血管内皮顶端细胞的形成、细胞密度、位置以及行为方式的调节,有效促进血管内皮细胞的正常分化和血管网的及时形成。这种机制也是肿瘤血管和血供的机制。如果抑制肿瘤细胞中的DLL4蛋白,将使新血管无法生成或失去功能,也就能大大减缓肿瘤的生长速度。
研究人员利用质粒DNA(独立于染色体之外、能自主复制的双链环状脱氧核糖核酸物质)为DLL4蛋白编码制作疫苗,然后对患乳腺癌的小鼠进行接种实验。结果证明,这种疫苗在小鼠体内产生了可抑制DLL4蛋白的抗体,并且极大地阻止了血管生成,从而抑制了体内乳腺肿瘤的生长。疫苗阻止血管生成可能会引起伤口愈合不良,但是检查发现,该疫苗并未影响小鼠的伤口愈合,也没有引起小鼠任何不良反应,说明这种疫苗值得进一步进行人体试验。
美国俄亥俄州克利夫兰医院的文森特·图伊等人发现,阿尔法乳白蛋白可以作为乳腺癌疫苗的抗原,因为该蛋白在患有乳腺癌的女性肿瘤组织中过度表达,而在健康女性的乳腺组织中则没有表达。当然,这种蛋白也在哺乳期女性的乳腺中表达。因此,阿尔法乳白蛋白可以用来制作疫苗,以诱导机体免疫系统抗御乳腺癌。
研究人员研制了含有阿尔法乳白蛋白的抗原疫苗,并以小鼠进行实验。他们把容易患乳腺癌的小鼠分为两组,一组注射阿尔法乳白蛋白抗原疫苗,另一组注射安慰剂。结果,接种了阿尔法乳白蛋白抗原疫苗的小鼠都没有发生乳腺癌,而没有接种该疫苗的小鼠则全部产生了乳腺癌。动物实验结果还表明,这种疫苗可以减小已形成的乳腺癌。因此,无论是对有乳腺癌高度风险的女性的预防,还是对于早期发现乳腺癌的女性,使用这样的疫苗都可以抑制肿瘤的生长和进一步恶化。现在图伊等人正在着手进行人体试验,从而评估该疫苗的安全性和剂量。
但是,由于哺乳期的女性也能表达阿尔法乳白蛋白,因此哺乳期女性不能接种这种疫苗。不过,患癌风险较高的40多岁的妇女哺乳几率很低,因此,这种疫苗的适用对象比较广泛,只是未来的前景还有待检验。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发