《Science》长文带您一览30年来基因编辑技术发展!
| 导读 | 在20世纪80年代始,基因编辑技术开始不断发展。而在CRISPR基因编辑技术横空出世之后,基因编辑技术有了突飞猛进的发展。而在近日,《Science》发表长文,列出了近年来基因治疗史上的一些重要突破。 |
在刚刚过去的2017年,美国FDA首次批准了两种针对血液疾病的CAR-T细胞免疫疗法和一种针对眼科遗传病的疗法Luxturna。1月12日,Cynthia E. Dunbar等六名科学家联名在《Science》上以《Gene therapy comes of age》为题发表了综述,文中论述了基因治疗史上的几大重要进展,并展望了基因治疗的未来。今天小编据此文整理了基因治疗发展史上的重大进展,以飨读者。
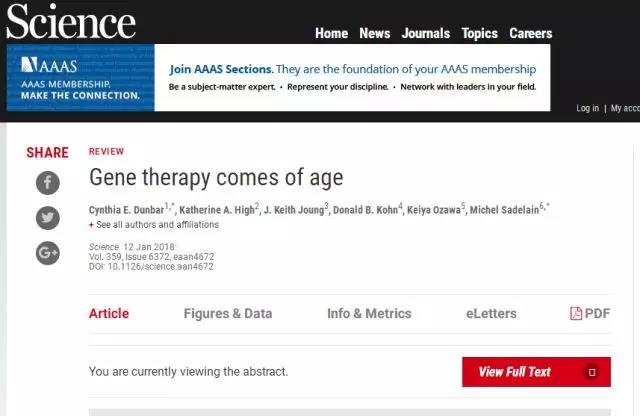
新的基因载体
随后慢病毒和泡沫病毒加入了载体库。慢病毒载体能使基因转移进入不分裂的细胞,与g-逆转录病毒载体相比,慢病毒载体可以携带更大更复杂的基因盒,因此为血液病的治疗提供了巨大助力。慢病毒载体和泡沫病毒载体还有另一优点,它们会优先整合到基因的编码区,这一特性有效避免了造血细胞中潜在的同基因插入诱变的风险。慢病毒载体是目前大多数HSC应用的首选工具,但是g-逆转录病毒载体在T细胞工程和HSC基因治疗中仍有所应用。
同时科学家们还试图去除慢病毒和g-逆转录病毒载体中的内源性强化元件,使用“自灭活”SIN设计降低遗传毒性风险。这个设计目前被用于大多数临床试验。
腺相关病毒(AAV)载体是从天然复制缺陷型非致病性非包膜细小病毒构建的。野生型AAV需要通过另一种病毒如腺病毒或疱疹病毒来复制。AAV载体的一个缺陷是它们不能包装大于〜5.0kb的DNA(而g-逆转录病毒载体或慢病毒载体可以容纳8kb)。AAV载体主要是非整合性的,其将转移的DNA作为附加体保持稳定。这一特征降低了整合的相关风险,但也限制AAV载体在有丝分裂细胞中的长期表达。
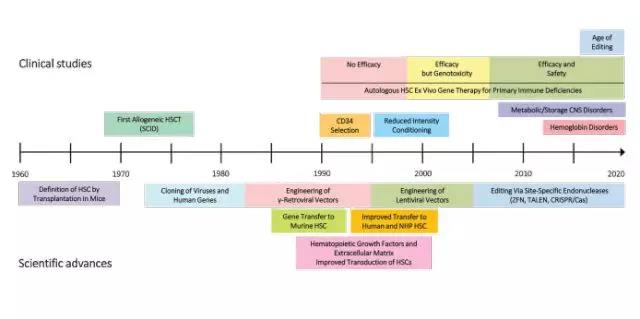
新的基因编辑技术
2009年的实证表明,细菌蛋白质的转录激活剂样效应子(TALEs)很容易被改变,从而为TALE核酸酶(TALENs)的创造打开了大门。这些酶可以有效地切割任何DNA序列。然而,TALEN法仍需为每个DNA设计一对特定的核酸酶。
2012年,基因组编辑格局发生了变化。Doudna和Char-pentier发现CRISPR-Cas9核酸酶组成的细菌防御系统可以通过设计与目标位点互补的特定短指导RNA(gRNA)来切割DNA。CRISPR-Cas9核酸酶技术迅速应用到哺乳动物细胞中,从而简化了编辑过程。TALENs和CRISPR-Cas9核酸酶实现了快速重新编程,现在广泛用于基础研究中。基因组编辑技术为修正或改变基因组提供了精确的解剖刀,并且克服了依靠病毒载体介导的半随机基因组插入的缺点。
基因组编辑进入临床的步伐越来越快。工程化的锌指核酸酶(ZFNs)已被用于破坏人类T细胞和HSCs中的CCR5(C-C基序趋化因子受体5型)的表达,帮助这些细胞抵抗HIV感染。 TALEN已被用于制造可防止移植物抗宿主病(GVHD)的CAR-T细胞。
此外,在急性骨髓性白血病和浆细胞样树突状细胞肿瘤中,TALEN编辑的CAR -T细胞的早期试验已经开始。同时,美国食品和药物管理局(FDA)已批准启动三项ZFN介导的治疗性基因体内插入肝细胞白蛋白基因座的临床试验,目的是为血友病B患者提供IX、aL 基因,并为II型粘多糖病(MPS II)患者提供艾杜糖醛酸-2-硫酸酯酶基因。体内基因组编辑治疗的第一位参与者最近参加了MPS II试验,通过AAV静脉输注,实现肝脏基因组的精准编辑。
另外,中国的监管机构也已经批准了至少九个CRISPR-Cas核酸酶的试验,主要是为了敲除肿瘤T细胞中的PD1表达,据报道已有几个试验入选了患者。

需要强调的是,与标准的基因转移方法相比,基因组编辑(特别是CRISPR-Cas核酸酶)仍处于其实验和临床初期阶段,仍存在一些潜在的可行性和安全性问题,可能会影响临床应用,这问题将需要进一步的临床前研究、适当的模型和精心设计的临床试验来一一克服。
单基因血液疾病和癌症的免疫疗法
20世纪90年代后期和21世纪初,研究人员使用g-逆转录病毒载体对T细胞进行基因编辑,引起编码白细胞介素-2受体或腺苷脱氨酶的基因的功能丧失,突结果显示重症联合免疫缺陷(SCID)患者的免疫功能明显改善。尽管g-逆转录病毒载体的HSC转导效率相对较低,但基因修饰的T细胞依旧能够扩增并填充T细胞区室。慢病毒载体获得的HSC的高转导效率使得基因治疗方法更广泛地应用于血液疾病和肿瘤的治疗。
另外,载体生产方法的优化,离体HSC操作和移植前细胞减灭术都有助于临床获益。慢病毒基因治疗的临床试验结果令人兴奋,在肾上腺脑白质营养不良的临床试验中,亦首次报道使用慢病毒载体进行的HSC基因治疗。目前已经开发了含有多种调节元件的慢病毒载体,其多中心临床试验正在进行。类似地,破坏基因组位点模拟的与遗传性白血病相关的遗传变异体,也有希望成为治疗镰状细胞性贫血的HSC基因组编辑的靶点。
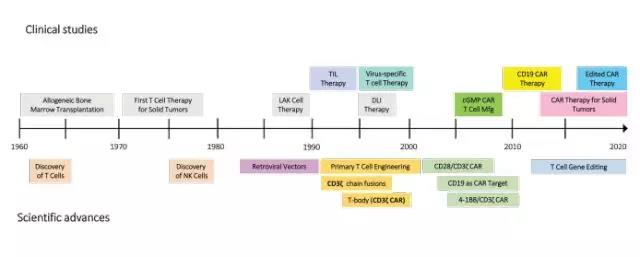
另外CD19 CAR-T在难治性急性淋巴细胞白血病(ALL)和弥漫大B细胞淋巴瘤(DLBCL)中的临床益处令人眼前一亮,2017年FDA就批准了两种基因工程细胞产品。目前的研究旨在将CAR治疗扩展到骨髓恶性肿瘤和实体瘤。此外,还需要促进CAR-T细胞进入大肿瘤或免疫特异性位点的方法学,了解T细胞的肿瘤微环境信号。CAR-T细胞对某些癌症的治疗有很大的影响,这为未来基于T细胞的治疗方法提供了基础。
过去的一年中,基因组编辑方面的进展一度突飞猛进,来自多个临床试验的成熟数据的发表显示了各种严重人类疾病的基因疫苗的有效性和安全性。在政府和慈善机构的支持下,从事基础研究和临床研究的科学家与临床医生将继续创新并提供新的或改进的技术。生物技术和制药行业越来越多地参与基因治疗,显示了该领域的成熟,并且有必要加速这些治疗手段的交付。但目前仍然存在许多挑战,例如通过整合基因递送载体或脱靶基因组编辑来处理基因毒性,将基因转移或编辑效率提高到能够有效治疗疾病的水平,解决重复体内施用载体引起的免疫应答,就有关争议的问题达成社会共识等等。未来,基因治疗将为人类健康带来的持久效益,这种疗法也将成为我们的标准治疗的一部分,我们坚信。(转化医学网360zhyx.com)
参考资料:Gene therapy comes of age
 腾讯登录
腾讯登录

还没有人评论,赶快抢个沙发