厉害了,曹雪涛连发2篇Cell及1篇Nature,在免疫学领域取得重大进展
| 导读 | iNature:2018年4月26日,曹雪涛研究组在Cell发表题为“Self-Recognition of an Inducible Host lncRNA by RIG-I Feedback Restricts ... |
iNature:2018年4月26日,曹雪涛研究组在Cell发表题为“Self-Recognition of an Inducible Host lncRNA by RIG-I Feedback Restricts Innate Immune Response”的研究论文,该论文揭示了免疫应答调节中的非规范自我识别模式,并展示了诱导性“自我”lncRNA作为有效分子诱饵的重要作用,其活跃地饱和RIG-I结合位点以限制“自我“RNA诱导的先天性免疫反应并维持免疫稳态,在炎症性疾病管理中具有潜在用途。另外,2018年3月30日,曹雪涛研究组发表题为“Tumor-Induced Generation of Splenic Erythroblast-like Ter-Cells Promotes Tumor Progression”的研究论文,该论文结果证实人类HCC患者中存在脾artemin阳性的Ter细胞,并显示血清artemin升高与预后不良相关。曹雪涛研究组表明Ter细胞和分泌的artemin在癌症进展中发挥重要作用,具有预后和治疗意义;同时2018年1月26日,曹雪涛研究组在Nature发表题为“Tet2 promotes pathogen infection-induced myelopoiesis through mRNA oxidation”的研究论文,该论文揭示了先前未知的Tet2在表观遗传转录水平的调节作用,在哺乳动物系统感染期间通过降低mRNA中的5-mC,促进成骨细胞生成。此外,胞嘧啶甲基化对双链RNA形成和mRNA中Adar1结合的抑制作用揭示了其在哺乳动物系统中的新的生理作用。
1曹雪涛研究组在RIG-I反馈自我识别诱导宿主lncRNA限制天然免疫反应取得重大进展
先天性免疫系统可以通过模式识别受体(PRR)感知入侵的病原体,以启动消除病原体的有效先天应答。作为最广泛研究的用于识别RNA病毒的PRR,视黄酸诱导型基因-I(RIG-I)已被证明可识别细胞质中的病毒RNA并通过产生I型干扰素(IFN)触发先天性免疫应答,和促炎细胞因子。众所周知,PRR触发的I型IFN过量产生,可能导致炎症性自身免疫性疾病。此外,观察到作为干扰素刺激基因(ISGs)之一的RIG-I可以被I型IFN和其他先天性刺激显着上调并且保持存在一段延长的时间。因此,必须精确调整相对持久的RIG-I的功能,尤其是在天然细胞因子(包括I型IFN)开始消失时的先天应答的晚期阶段。然而,有效终止先天细胞因子诱导的RIG-I活化的机制仍然大部分未知。
已经确定了RIG-I作为先天RNA传感器来区分“非自身”病毒RNA与“自身”RNA的能力。当病毒感染产生在ATP存在下与RIG-I C-末端结构域(CTD)的基本裂隙结合的致病性RNA时,RIG-I变为“开放”结构,暴露CARD与解旋酶域。释放的CARD介导下游信号激活先天应答。提出具有5'-三磷酸的短平末端双链RNA是RIG-I活化的致病性RNA的关键特征 。然而,RIG-I能否在生理上结合自身RNA及其功能重要性仍然未知。
在过去的几年中,许多长的非编码RNA(lncRNA)通过与特定蛋白质结合而成为各种生理和病理过程中的重要调控分子。最近,交联后免疫沉淀的RNA(CLIP-seq)的高通量测序分别鉴定了人和小鼠中的21073和1662个RNA结合蛋白(RBP)-ncRNA相互作用。然而,lncRNA与RBPs在免疫和炎症中相互作用的生物学意义和潜在机制有待进一步研究。越来越多的证据表明RBP-lncRNA与蛋白质功能的相互作用激发我们去问RIG-I能否与“自我”细胞lncRNA结合,如果是这样,这种自我识别在维持免疫中的生物学功能和重要性如何稳态通过反馈限制或及时终止RIG-I对“非自身”RNA诱导的先天性炎症反应的识别?
在这里,曹雪涛研究组确定宿主来源的干扰素诱导长非编码RNA,lnc-Lsm3b,它可以与RIG-I单体结合中的病毒RNA竞争,反馈使先天反应晚期的RIG-I功能失活。从机制上讲,lnc-Lsm3b的结合限制了RIG-1蛋白的构象转变并阻止了下游信号传导,从而终止了I型IFN产生。多价结构基序和长茎结构是lnc-Lsm3b对于RIG-I结合和抑制的关键特征。这些数据揭示了免疫应答调节中的非规范自我识别模式,并展示了诱导性“自我”lncRNA作为有效分子诱饵的重要作用,其活跃地饱和RIG-I结合位点以限制“自我“RNA诱导的先天性免疫反应并维持免疫稳态,在炎症性疾病管理中具有潜在用途。
2曹雪涛研究组在肿瘤诱导的脾成红细胞样Ter细胞的生成促进肿瘤进展取得重大突破

识别肿瘤诱导的白细胞亚群及其衍生的循环因子,有助于将癌症理解为全身性的疾病。尽管如此,远端器官原发性肿瘤诱导的非白细胞数量如何导致全身性传播尚不明确。
在这里,曹雪涛研究组报告了一个群体的肿瘤诱导,有核红细胞样细胞(Ter细胞)来源于巨核细胞 - 红细胞祖细胞,同时具有独特的Ter-119 + CD45-CD71 +表型。 Ter细胞富集于携带晚期肿瘤的宿主脾肿大,并通过将神经营养因子artemin分泌到血液中促进肿瘤进展。在Ter细胞生成中,转化生长因子β(TGF-β)和Smad3激活是重要的。
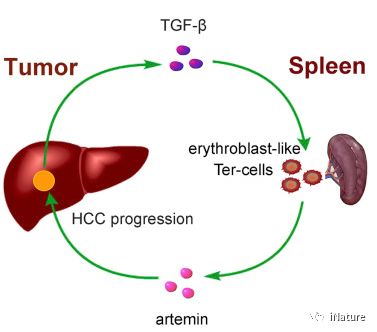
作用模型
来自Ter细胞的artemin的体内阻断抑制肝细胞癌(HCC)的生长,并且artemin缺乏会破坏Ter细胞的促肿瘤能力。曹雪涛研究组的结果证实人类HCC患者中存在脾artemin阳性的Ter细胞,并显示血清artemin升高与预后不良相关。曹雪涛研究组建议Ter细胞和分泌的artemin在癌症进展中发挥重要作用,具有预后和治疗意义。
3曹雪涛研究组揭示TET2在炎症应答中的新功能

TET酶的发现是表观遗传学中最大的发现之一。他们提供了一个主要假设的途径:活性DNA去甲基化的机制基础。在染色体10和11之间可以发生易位,从而产生MLL-TET1融合蛋白。在过去的5年中,TET蛋白已被证明可以催化5-甲基胞嘧啶(5mC)的迭代去甲基化步骤。首先将5mC转化为5-羟甲基胞嘧啶(5hmC),然后分别通过TET1-3转化为5-甲酰基胞嘧啶(5fC),然后转化为5-羧基胞嘧啶(5caC)。 5fC和5caC都可以通过末端脱氧核苷酸转移酶(TdT)转化为未修饰的C。
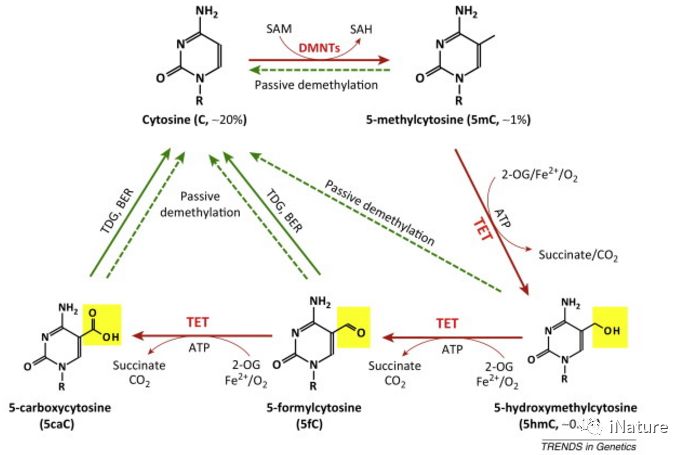
DNA去甲基化途径概述
所有三种TET酶都具有使用O2使α-酮戊二酸脱羧的CD(Cys-富含和DSBH区域)结构域,从而生成将5mC转化成5hmC的高价态氧化铁(以及5hmC→5fC→5caC)。 TET1和TET3也有一个CXXC域,尽管TET2没有。 CXXC结构域通常结合未甲基化的CpG二核苷酸,但是在TET酶中它们结合5mC和5hmC。 CXXC结构域的确切作用尚未完全了解,但可能涉及将酶靶向基因组的特定区域。
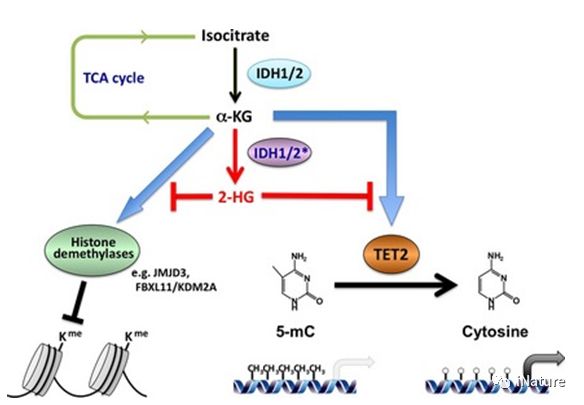
TET2潜在的作用
TET酶的表达水平和细胞类型分布也不同。在胚胎干细胞中发现TET1 / 2,而在生殖系中发现TET3。这些差异的意义以及TET如何调控的机制在很大程度上还是未知的。这些酶的潜在生物学作用正在变得清晰。怀疑TETs和5mc衍生物在发展中是重要的。父本染色体的活性DNA去甲基化是受精合子早期发育的重要组成部分。 TET介导的DNA去甲基化可能对这一过程至关重要。关于5hmC的最有趣的发现是其在人脑中的显着丰富。它被认为在基因表达的调控中起作用,但是这个基地的许多方面仍然是推测性的。
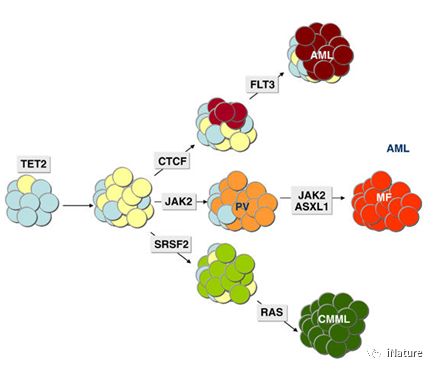
TET2在炎症中潜在的作用机制
另外,天然免疫系统一旦感知到病原体感染,会马上诱导产生大量天然免疫细胞并通过促发炎症反应以期清除入侵的病原体,但天然免疫与炎症反应是一把双刃剑,过度活化会损伤机体。如何有效适度地平衡调控天然免疫与炎症反应的发生与终止,是免疫学领域的一个重大科学问题。
直到最近,TET蛋白质在果蝇中氧化RNA 5-羟甲基胞嘧啶(5-hmC)的功能才被揭示。然而,哺乳动物mRNA中5-mC的转换和功能尚不清楚。Tet2主要以酶活性依赖的方式抑制髓系恶性肿瘤,并且以非活性依赖性的方式去应对炎症。髓细胞生成是急性和慢性感染中常见的宿主免疫应答;然而,它的表观遗传机制需要被确定。在这里,曹雪涛研究组表明,Tet2通过降低对于细胞因子诱导的髓系生成至关重要的JAK-STAT途径的关键负调节因子Socs3的mRNA水平,来促进腹部败血症诱导的紧急性骨髓生成和寄生虫诱导的肥大细胞扩增。
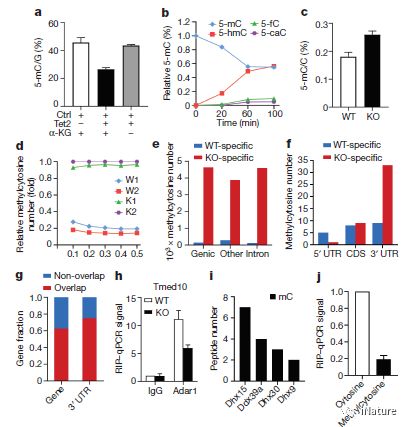
TET2降低mRNA甲基化水平
Tet2通过Adar1抑制Socs3表达,其以不依赖于RNA编辑的方式结合和破坏Socs3 mRNA的稳定性。对于mRNA水平上Tet2调节的潜在机制,曹雪涛研究组认为Tet2是介导mRNA中5-mC的氧化。 Tet2缺陷导致甲基化胞嘧啶的转录组范围外,包括Socs3的3'非翻译区中的那些,其可能通过胞嘧啶甲基化特异性读出器如RNA解旋酶影响Adar1结合的双链RNA形成。
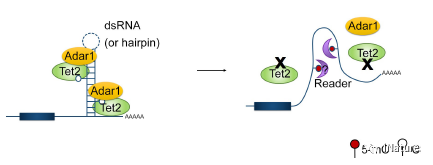
TET2作用model
曹雪涛研究组揭示了先前未知的Tet2在表观遗传转录水平的调节作用,在哺乳动物系统感染期间通过降低mRNA中的5-mC,促进成骨细胞生成。此外,胞嘧啶甲基化对双链RNA形成和mRNA中Adar1结合的抑制作用揭示了其在哺乳动物系统中的新的生理作用。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发