应用全外显子测序发现男子不育症新致病基因
| 导读 | 这些基因一般位于精子生成的信号通路上,并且具有多物种保守性.与之相对的是,如果是近亲家庭结婚引起的NOA,则通过二代测序... |
背景介绍
不孕不育症,是指成人男女双方同居一处并有正常性生活一年以上,无避孕措施仍无法怀孕,影响全球高达15%的夫妇,大约50%的不育症是男性因素,由各种生精异常引起。最严重的是非阻塞性无精症(NOA),尽管生殖器官没有阻塞,但完全没有精子。非阻塞性无精症占男性不育症的10%-15%,因此约有1%的成年男性都受该病影响。
NOA的典型临床评估包括收集病史排除隐睾症,腮腺炎性睾丸炎,之前是否接受过放疗和化疗,并进行体格检查以排除可能导致精子缺乏的阻塞性原因。随后的实验室检查包括精液分析,激素评估,染色体异常检测和Y染色体微缺失检测。以上这些评估和检查只能解释NOA病例约30%的原因,通常大家认为,许多特发性病例具有遗传原因,人类已经发现有55个基因变异与NOA密切相关,在小鼠模型中已经发现有数百个基因影响精子生成,之前很少研究涉及遗传性因素究竟在NOA占到多大的比例。寻找特发性男性NOA遗传因素的挑战在于其高发病率表明高度遗传异质性。因此,在没有血缘关系的群体中,需要招募大量受影响的男性,以找到可能共有相同致病突变或罕见的破坏性突变,这些基因一般位于精子生成的信号通路上,并且具有多物种保守性。与之相对的是,如果是近亲家庭结婚引起的NOA,则通过二代测序技术一个家系就可能找到致病基因(游侠补充:该测序策略同样适用于其他遗传病)。
基于以上认识,我们觉得应用全外显子测序(WES)应该可以在近亲家庭中发现新的NOA致病基因,我们的方法包括两个部分,第一是在近亲大家系中发现新致病基因,第二是在散发患者中检测已知基因和新发现基因的携带情况。
入组患者
8个大家系33名患者,75个NOA散发患者,74个正常对照。
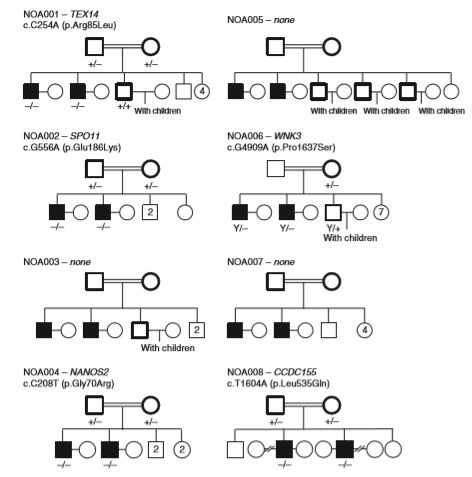
测序与分析
采用Agilent V5进行捕获测序,平均测序深度94.6X,排除以下位点1)不符合家系共分离位点;2)正常人群频率高于0.01的位点;3)内含子区,非翻译区位点;4)PolyPhen和CADD预测容忍的位点,PhastCONS与GERP认为处于非保守区的位点。
寻找睾丸特异高表达的基因
主要基于Genotype-Tissue Expression Project (http://www.gtexportal.org)和HumanProtein Atlas (http://www.proteinatlas.org),在19556个基因中只有1051个基因在睾丸中特异高表达,标准为在睾丸中表达水平是排名第二位组织的5倍以上。
NOA相关基因列表
由作者在pubmed文献检索获得NOA相关基因列表,共计57个,与阻塞性NOA、精子运动缺陷、少精症相关的基因被排除在外,具体包括1)位于Y染色体AZF区9个基因;2)NOA患者队列中发现的13个候选致病基因;3)具有统计学差异的但是在正常人群中也有很少出现的29个候选关联基因;4)大家系中连锁与共分离发现的6个基因。
结果
通过上面提到的数据分析参数,只有12个基因(纯合)在6个大家系中被鉴定出来。其中5个基因在睾丸组织中特异高表达。
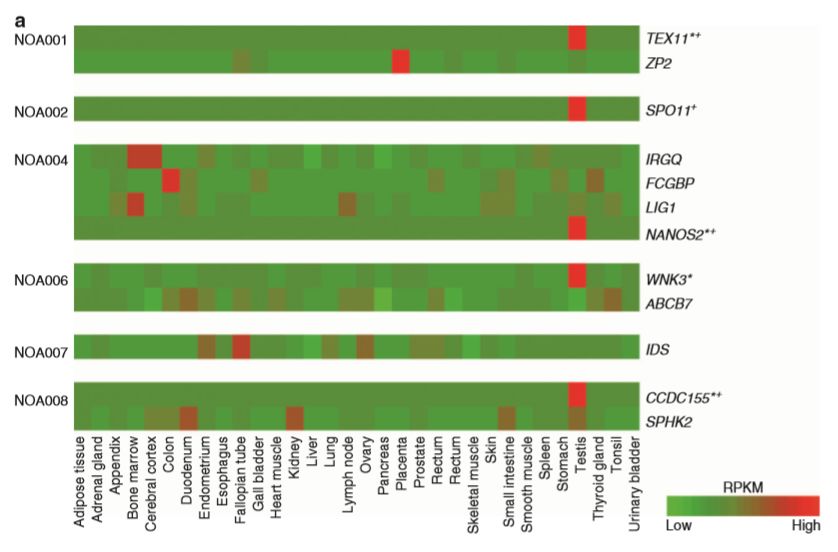
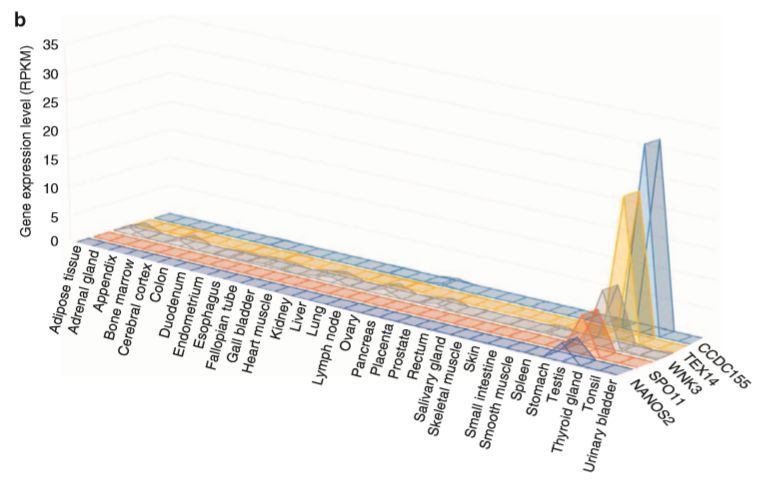
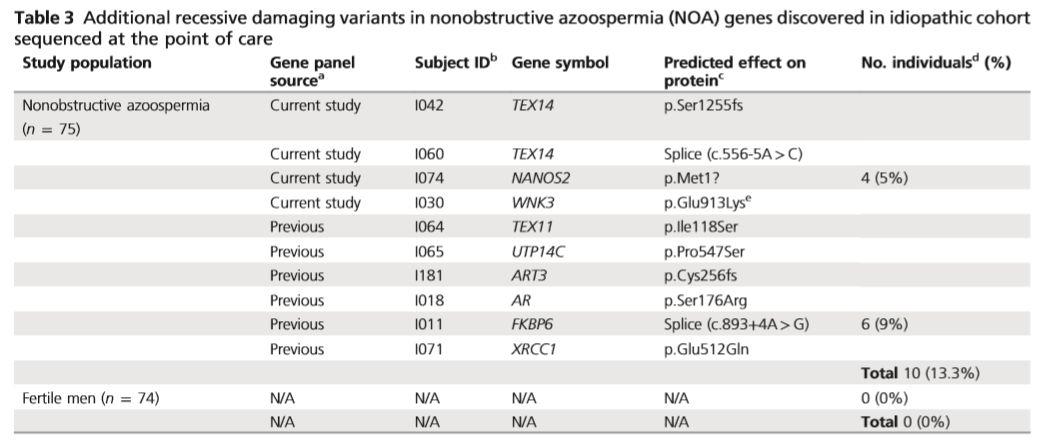
在小鼠敲除模型数据库中发现,5个基因中的4个(Ccdc155, Nanos2, Spo11, and Tex14)被敲除后影响小鼠精子生成。另外一个Wnk3,敲除后激活了Nkcc1,引起小鼠不育。在75个散发NOA患者中,有4例患者携带5个新发现基因中的3个,进一步支持了新基因与NOA的相关性。在随后的分析中发现有6个散发患者携带57个已知致病基因的变异,而在74个正常对照中未发现。
结论
总之,对于所有在常规评估后仍保留特发性的NOA患者,在临床检查中引入WES可能有助于人类不孕的研究。当与数百个基因参与小鼠生殖异常的功能性证据相结合和人类睾丸特异性基因表达模式时,该策略可能提高诊断率和发现新型男性不育基因。
游侠点评
近亲家庭导致的遗传病可提高发现新基因成功率,与表达数据结合和小鼠模型可进一步锁定致病基因。62个NOA基因列表可为临床检测提供参考,1051个基因列表可为发现睾丸新基因提供参考。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发