使前总统卡特黑色素瘤痊愈的免疫治疗药物PD-1抑制剂,现已获CFDA批准上市!
| 导读 | 免疫治疗明星药物Keytruda(Pembrolizumab)中文名为齐内达(派姆单抗)获中国食品药品监督管理局CFDA批准上市,最近国家对抗癌药物的审批大开绿灯,上个月刚获批了Opdivo药,这个月Keytruda也获批上市了,从递交到获批用时不到6个月,创下了中国进口抗肿瘤生物制剂的最快审批记录。对于国内的 |
免疫治疗明星药物Keytruda(Pembrolizumab)中文名为齐内达(派姆单抗)获中国食品药品监督管理局CFDA批准上市,最近国家对抗癌药物的审批大开绿灯,上个月刚获批了Opdivo药,这个月Keytruda也获批上市了,从递交到获批用时不到6个月,创下了中国进口抗肿瘤生物制剂的最快审批记录。对于国内的患者来说这是一个好消息,再也不用去海外买免疫药物了。

起底PD-1抑制剂
91岁高龄的前总统吉米.卡特宣布自己罹患晚期黑色素瘤,病灶最早在其肝脏发现,后来又转移到了大脑。随后,卡特接受了手术、放疗和一种新型免疫治疗,如今卡特已宣布痊愈。
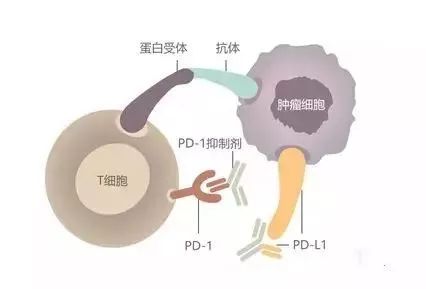
这种免疫药物就是如今在肿瘤患者和医生中大名鼎鼎的免疫检查点抑制剂PD-1抑制剂,免疫治疗是通过调节人体自身的免疫细胞来治疗肿瘤的治疗方法,PD-1抑制剂已经是继手术,放疗和化疗之后的第四种肿瘤治疗方法。
癌症的出现是由于负责操控细胞功能(尤其是生长和分裂部分)的基因出现变异所致,与免疫系统的关系密不可分,正常情况下免疫系统不但协助人体抵抗疾病及感染,还助于对抗癌症,但癌症或癌症治疗却会削弱免疫系统功能,免疫疗法能协助免疫系统辨识及针对癌细胞进行攻击,更具针对性同时还具备记忆功能,因此效用较其他治疗更持久。
Keytruda适应症
Keytruda的适应症有黑色素瘤、肺癌、头颈癌、经典霍奇淋巴瘤、原发性纵膈大B细胞淋巴瘤、尿路上皮癌、微卫星不稳定性-高(MSI-H)癌症、胃癌、宫颈癌。
黑色素瘤:此次上市中国主要针对晚期恶性黑色素瘤,也是目前国内唯一获批针对黑色素瘤的PD-1抑制剂,黑色素瘤一种恶性肿瘤,常见于皮肤黏膜等部位,晚期患者生存率只有15-20%。
肺癌:无论是鳞癌还是非鳞癌、PD-L1表达与否Keytruda都可应用于非小细胞肺癌和小细胞肺癌的治疗。
胃癌:美国FDA已经批准Keytruda用于胃癌,临床数据显示,Keytruda针对PD-L1阳性的1b期胃癌患者的客观反应率(ORR)为30%。客观反应率(ORR)指的是患者的用药之后肿瘤至少缩小30%。
肝癌:7月11日美国FDA接受Keytruda晚期肝癌治疗申请并授予优先审评资格,Keytruda在经索拉非尼治疗后的肝细胞癌患者中客观反应率(ORR)为16.3%(这与CheckMate-040研究中Opdivo的数据相似),其中完全缓解1例。中位PFS为4.9月,中位OS为12.9月,1年PFS和OS的比例分别为25.4%和53.6%。
结直肠癌:临床数据显示,默沙东的Keytruda对MSI-H的肠癌患者的客观反应率为62%;对MSS的肠癌患者ORR是0;对MSI-H的其他实体瘤患者,ORR是60%。
微卫星不稳定性-高(MSI-H)癌症:2017年5月23日,FDA批准Keytruda用于治疗微卫星高度不稳定性(MSI-H)或携带错配修复(MMR)基因缺失的实体瘤。这个就是轰动一时的广谱抗肿瘤药的获批!意思就是说,只要微卫星高度不稳定性(MSI-H)或携带错配修复(MMR)基因缺失的实体瘤,不管是什么实体瘤,都有比较好的疗效!
食管癌:临床结果显示,Keytruda针对PD-L1阳性的食管癌,总的客观反映率是30%。在17位鳞癌患者中,ORR是29%;在5位腺癌患者中,ORR是40%。
壶腹部、胰腺、胆管和小肠癌:Keytruda针对非肠癌的消化道肿瘤的临床数据,经过5.3个月的回访,总的ORR是47%:25%的患者完全缓解,24%的患者部分缓解。总的疾病控制率76%。完全缓解的4位患者包括:2位胃癌,1位壶腹部癌和1位胆管癌。中位生存期21个月,18个月的生存率86%。
宫颈癌:2018年6月13日,美国FDA批准Keytruda用于治疗化疗期间或化疗后病情进展的PD-L1表达≥1%的复发性或转移性宫颈癌。值得一提的是,Keytruda是首款获批治疗晚期宫颈癌的PD-1疗法。
市场竞争激烈
百时美施贵宝的Opdivo和默沙东Keytruda于2014年FDA批准上市,随后FDA还批准上市了罗氏的Tecentriq、德国默克/辉瑞的 Bavencio和阿斯利康的Imfinzi市场竞争激烈。6月15日CFDA正式批准百时美施贵宝的Opdivo上市,用于治疗非小细胞肺癌NSCLC成为我国首个批准上市的PD-1抑制剂产品。默沙东Keytruda在2月11日提交上市申请针对晚期恶性黑色素瘤,今天获批从递交到获批用时不到6个月,创下了中国进口抗肿瘤生物制剂的最快审批记录。
百时美施贵宝的Opdivo和默沙东Keytruda在欧美竞争激烈,所以抓紧布局中国这个庞大的市场,好在国内的企业竞争意识强烈,也纷纷加快研发上市的步伐,下一个最有希望获得CFDA批准上市的就是信达生物的PD-1单抗信迪利单注射液,接下来让我们一起看一下国产PD-1的研发实力。
信达生物
今年4月19日,信达生物重新提交的PD-1单抗信迪利单注射液的上市申请正式获得药品审评中心承办受理。2017年12月13日,信达生物提交的信迪利单抗注射液(IBI308)的首次上市申请获得CDE承办受理,也是首个国产PD-1/PD-L1单抗的上市申请。信达生物使用信迪利单抗的国内临床数据向FDA提交了美国新药临床研究申请(IND),已经获得FDA的临床许可,并且准许跃过I期临床直接进入美国II/III期临床研究。这标志着信迪利单抗注射液在安全性和有效性方面获得了美国FDA的初步认可。
君实生物
2018年3月9日,君实生物发布公告称其重组人源化抗PD-1单克隆抗体注射液(JS001)于近日正式获得CFDA的新药申请受理通知书。JS001的中文名称正式亮相——特瑞普利单抗。据君实生物负责人透露,此次获得受理的申请是JS001的新药上市申请,适应症为黑色素瘤。JS001是国内企业首个获得CFDA 临床试验批件的抗 PD-1单克隆抗体注射液,目前正与国内多家临床中心开展黑色素瘤、鼻咽癌、胃癌、肺癌、食管癌、尿路上皮癌等10余个适应症 I~III 期临床试验。JS001于2018年1月获得FDA临床试验批准,是君实生物首个在全球开展临床试验的生物制品。
恒瑞医药
恒瑞医药代表性重磅产品有如下四种:PD-1单抗,是中国第二个获得WHO非专利药物名的国产生物药,首个获得WHO非专利药物名的国产单抗药物,目前已进入III期临床;升白药HHPG-19K(19K),为长效聚乙二醇化重组人粒细胞集落刺激因子(CSF),属于I类创新药,目前该产品已处于保生产阶段,国内进度遥遥领先,有望成为10亿量级重磅品种;PD-L1单抗目前已经批准进行临床试验,可与公司PD-1单抗和其他抗肿瘤药物形成;C-Met ADC,中国第一个获得 FDA 临床批准的抗体药物偶联物。
百济神州
百济神州是首个赴美上市的中国创业型生物制药企业,公司瞄准国际前沿,从小分子靶向化学新药和大分子免疫抗肿瘤生物新药两路进发,同时布局10多个新药的研发。公司近期公布其在研PD-1抗体tislelizumab治疗复发/难治性经典霍奇金淋巴瘤(R/R cHL)中国患者的关键性Ⅱ期临床试验的独立评审的初步主要结果。针对70例自体干细胞移植(ASCT)失败或不适合ASCT的cHL患者,试验结果显示:总缓解率(ORR)为73%,包括50%的完全缓解率(CR),中位缓解持续时间尚未达到,且安全性与先前报道的Ⅰ期临床总体数据一致。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发