《自然医学》双重磅:科学家首次利用基因编辑技术在动物体内修复线粒体DNA突变,线粒体遗传病终于迎来治疗希望 | 科学大发现
| 导读 | 今天,基因编辑技术再次迎来里程碑事件。来自剑桥大学的研究团队和迈阿密大学米勒医学院的研究团队,背靠背在著名期刊《自然医学》上发表了两篇重要的研究论文。 |
今天,基因编辑技术再次迎来里程碑事件。
来自剑桥大学的研究团队和迈阿密大学米勒医学院的研究团队,背靠背在著名期刊《自然医学》上发表了两篇重要的研究论文。
他们分别使用老牌的基因编辑技术ZFN[1]和TALENs[2]成功在活体内消除了线粒体中导致疾病的突变DNA(CRISPR因为多种原因,没能拔得头筹)。
这是科学家首次用基因编辑技术在体内编辑线粒体DNA;此外,这两个研究也让线粒体疾病(耳聋、癫痫、肌肉无力等)这类常见的、无药可医的遗传病首次迎来治愈的希望。
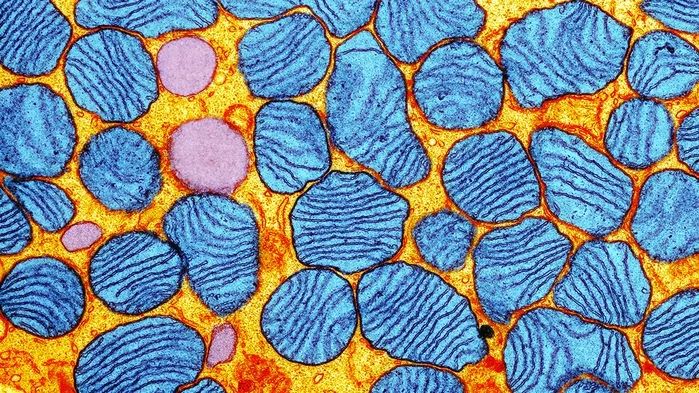
线粒体号称人体的“能量工厂”,它的重要性不言而喻。线粒体内有一套独立于细胞核的遗传物质——线粒体DNA(mtDNA),在人体的能量代谢中起到非常重要的作用。与细胞核内的DNA不一样的是,每个细胞中的mtDNA拷贝数从100到10000不等[3]。
mtDNA突变会导致能量代谢障碍,临床症状非常复杂(很多器官会表现出衰竭)。据统计,每5000个人里面至少有一个人患mtDNA突变导致的遗传病[4]。
不过呢,在大部分患者体内,并不是所有的mtDNA都突变了,而是突变的mtDNA与正常的mtDNA共存[5],患者疾病的严重程度,与二者之间的比例有关。

卵细胞在形成过程中,携带的突变mtDNA比例是不一样的
突变的mtDNA占比越高,患者的疾病越严重;只要突变的mtDNA占比足够低,携带突变的人可能不会表现出症状。通常情况下,突变mtDNA达到60%,携带者就表现出疾病症状。因此,消除患者体内突变的mtDNA,让正常的mtDNA重回巅峰,是治疗线粒体疾病的重要策略之一。
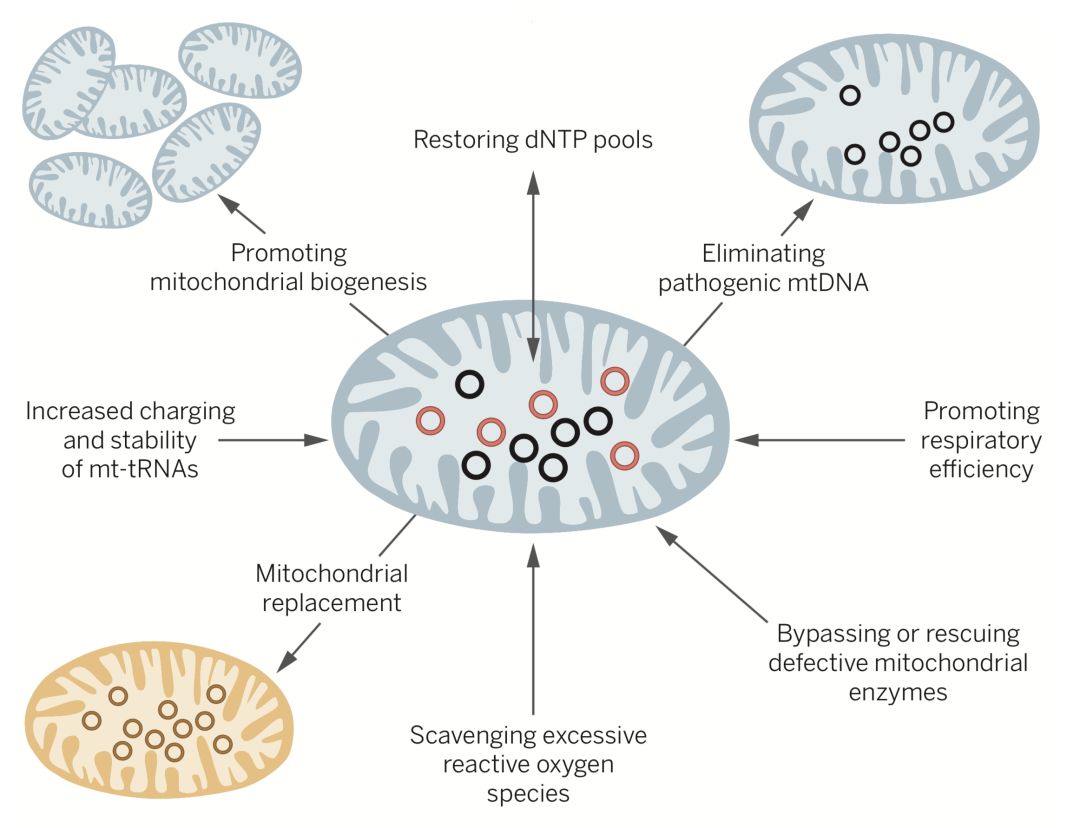
线粒体DNA突变的可能治疗手段(右上角提到的就是消除突变的mtDNA)
基因编辑就是那种能消除突变mtDNA的技术。只要用基因编辑技术切断突变的mtDNA,线粒体就会自动清除它们。同时为了保持线粒体内DNA数量的稳定,新的mtDNA又会合成,正常的mtDNA就有机会变得更多了。
其实在培养皿里,科学家已经使用ZFN[6]和TALENs[7]成功消除了细胞的突变mtDNA。在复杂的动物体内,基因编辑技术还能不能奏效还未可知。
来自剑桥大学Michal Minczuk和Payam Gammage团队采用的是ZFN编辑系统。他们将切割特定位点的ZFN编辑系统放到靶向心肌细胞的载体病毒中,通过尾部静脉注射到小鼠体内,病毒载体很快就把ZFN编辑系统投放到心脏了。
分析数据发现,给小鼠注射中等剂量的病毒载体后,小鼠心脏细胞内的突变mtDNA比例从73%下降到37%,降低近50%。不仅如此,小鼠的心脏代谢功能也得到明显改善。
来自迈阿密大学米勒医学院的Carlos Moraes和Sandra Bacman团队,设计思路跟Minczuk和Gammage团队类似,只不过用的是TALENs编辑系统。研究人员也观察到突变的mtDNA降低50%左右,这促使突变的mtDNA占比低于50%。
剑桥大学和迈阿密大学团队开展的体内实验的成功,让他们对人体研究充满期待。Moraes在接受《科学》杂志采访时表示,他们正在尝试组织一项关于mtDNA突变治疗的人体安全性试验,可能在明年开始招募受试者[8]。

很多读者可能比较疑惑,为什么这次编辑线粒体用了ZFN和TALENs,却唯独没有使用更便捷的CRISPR。
实际上研究人员在尝试编辑线粒体的时候考虑过CRISPR,但是他们认为有两个条件限制了CRISPR在线粒体中的应用:一,线粒体空间太小,CRISPR没法施展;二,与ZFN和TALENs不同的是,CRISPR编辑的时候需要引导RNA,这个RNA究竟如何才能进入线粒体,目前还不清楚[9]。
最后,关于线粒体疾病,关注度最高的莫过于“三亲婴儿”了。这种婴儿的精子来自一个人、卵细胞核来自一个人、卵细胞的线粒体来自另外一个没有线粒体疾病的人。2016年,华人医学博士张进缔造了全球第一例“三亲婴儿”。
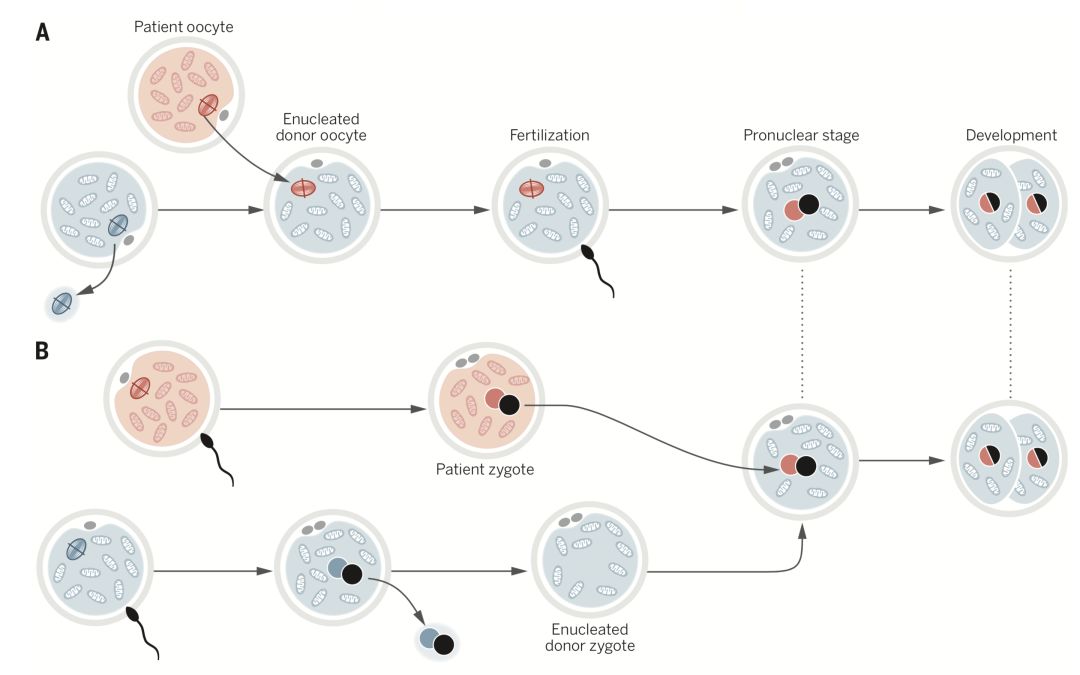
“三亲婴儿”胚胎技术路线
撇开“三亲婴儿”面临的伦理问题不说,这项技术实际上是一项预防线粒体疾病的技术。对于很多mtDNA突变的携带者而言,她们可能并不会意识到自己需要这项技术。因此线粒体疾病并不容易预防。
鉴于目前线粒体疾病这一大类疾病还没有有效的疗法,剑桥大学和迈阿密大学团队的这两个研究,给此类疾病的治疗带来了希望。
编辑神叨叨
更多基因编辑的研究和故事,Medical Trend都有……
参考资料:
[1].Payam Gammage, et al. Genome editing in mitochondria corrects a pathogenic mtDNA mutation in vivo[J]. Nature Medicine, 2018.
[2].Sandra Bacman, et al. MitoTALEN reduces mutant mtDNA load and restores tRNAAla levels in a mouse model of heteroplasmic mtDNA mutation[J]. Nature Medicine, 2018.
[3].Wachsmuth M, Hubner A, Li M, et al. Age-Related and Heteroplasmy-Related Variation in Human mtDNA Copy Number[J]. PLOS Genetics, 2016, 12(3).
[4].Gorman G S, Schaefer A M, Ng Y, et al. Prevalence of nuclear and mitochondrial DNA mutations related to adult mitochondrial disease[J]. Annals of Neurology, 2015, 77(5): 753-759.
[5].Gorman G S, Chinnery P F, DiMauro S, et al. Mitochondrial diseases[J]. Nature Reviews Disease Primers, 2016, 2: 16080.
[6].Gammage P A, Gaude E, Van Haute L, et al. Near-complete elimination of mutant mtDNA by iterative or dynamic dose-controlled treatment with mtZFNs[J]. Nucleic acids research, 2016, 44(16): 7804-7816.
[7].Bacman S R, Williams S L, Pinto M, et al. Specific elimination of mutant mitochondrial genomes in patient-derived cells by mitoTALENs[J]. Nature Medicine, 2013, 19(9): 1111-1113.
[8].http://www.sciencemag.org/news/2018/09/zapping-mutant-dna-mitochondria-could-treat-major-class-genetic-disease
[9].https://medicalxpress.com/news/2018-09-mitochondria.html(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发