DNA甲基化 |“双面间谍”或将为癌症治疗带来新思路!
| 导读 | 在DNA“字母表”中,除了四个主要碱基A、T、C、G之外,还有“第五”碱基:5-甲基胞嘧啶(5-mC),其在决定基因和其他DNA元件打开或关闭上起着不同程度的作用。毫无疑问,胞嘧啶甲基化的缺陷与发育异常、遗传疾病以及癌症有关。 |
作者:Echo
在DNA“字母表”中,除了四个主要碱基A、T、C、G之外,还有“第五”碱基:5-甲基胞嘧啶(5-mC),其在决定基因和其他DNA元件打开或关闭上起着不同程度的作用。毫无疑问,胞嘧啶甲基化的缺陷与发育异常、遗传疾病以及癌症有关。
最新的一项研究中,La Jolla免疫研究所的研究人员揭示了DNA的甲基化和去甲基化之间的平衡是如何阻止基因组不稳定性,进而阻止癌症发展的。
科学家们已经知道,DNA甲基转移酶DNMT(哺乳动物细胞主要含 3 种 DNMT,DNMT1 主要维持甲基化, DNMT3a 和 DNMT3b 催化 DNA 的从头甲基化)能够将甲基基团转移到胞嘧啶(C),从而生成5-甲基胞嘧啶(5-mC)。但是去甲基化是如何发生的,几十年来仍然是个谜。直到Anjana Rao博士等人对一种癌症相关蛋白TET(Ten-Eleven translocation)进行了研究,发现其可以将5-mC转化为5-羟甲基胞嘧啶(5-hmC),并接着恢复为C。此后的研究发现,TETs功能的丧失与人类和小鼠中许多类型的癌症密切相关。
尽管看起来DNMTs和TETs有着相反的表现:DNMTs使C转化为5-mC,而TETs负责5-mC的去甲基化,逆转这一过程。然而却有研究表明,人类血液癌症中TET2或者DNMT3a的突变却显示出类似的特征,比如DNA损伤水平和基因组不稳定性的增加。
此外,TET2和DNMT3a是克隆性造血中突变最多的两种蛋白质。克隆性造血是一种与衰老有关的疾病,由造血干细胞的内部衰老与外部环境共同作用而形成。克隆性造血的人,有动脉粥样硬化和进行性癌症的风险。
这项最新研究,解释了为什么TETs和DNMTs的突变在疾病中具有相似的作用。
该研究的第一作者, Rao实验室的研究生IsaaC F. López-Moyado,分析了小鼠T细胞中TET 2和TET3被删除后,所产生的侵袭性淋巴瘤的甲基化模式。他发现,DNA甲基化在基因组大范围增加,正如预期的那样。
然而,与正常的、非癌变的T细胞相比,这些癌症样本具有同样大的基因组区域,其丢失了DNA甲基化。
作者表示大吃一惊,因为过去的观点是,TET突变导致DNA甲基化增加。虽然对于某些基因组区域来说的确是这样,但对于异染色质而言并非如此。异染色质是一种紧密堆积的DNA形式,为非活性转录区,其位于细胞核的外围。真核生物可以通过异染色质化而关闭基因的表达。
接下来,研究人员仔细观察了DNMT3a分子在TET缺陷细胞中的分布,发现DNMT3a分子的一部分,已经从异染色质重新定位。这解释了该基因组区域中的甲基化丢失现象。
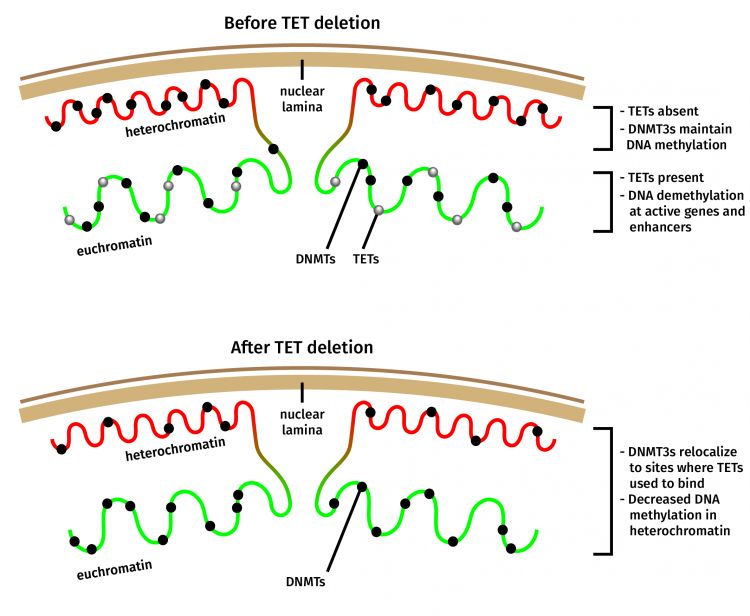
有意思的是,许多白血病患者同时携带TET2和DNMT3a突变,并且携带TET2和DNMT3a双重突变的小鼠,比仅仅携带TET2或者DNMT3a突变的小鼠产生更加严重的癌症。López-Moyado分析了来自小鼠造血干细胞(造成血液癌症的细胞)的公布数据,以确定双重突变是否与异染色质的甲基化状态变化相关。
López-Moyado发现,具有TET2和DNMT3a双重突变的细胞,在异染色质中显示出比仅具有这些突变之一的细胞更显著的DNA甲基化损失。事实上,即使没有TET或DNMT3a突变,异染色质中DNA甲基化的减少在癌症中也很常见,这可能涉及到TET或DNMT功能的丧失。
“如果异染色质失去DNA甲基化,这些元件可能会重新激活并形成异常结构,或从一个基因组位置跳到另一个基因组位置,导致基因组不稳定和DNA损伤,这是癌症的标志,”López-Moyado解释道。实际上,在许多类型的遗传性和非遗传性癌症中,通常观察到这些特征以及DNA低甲基化,包括具有TET和DNMT3a突变的癌症。
未来的研究将确定异染色质中由DNA甲基化途径突变引起的DNA甲基化的丢失,是否直接作用于异染色质再激活以及癌症起始和进展。(转化医学网360zhyx.com)
参考资料:
https://www.lji.org/news-events/news/post/tet-proteins-double-agents-in-dna-methylation-prevent-catastrophic-cancer/
2019第三届现代临床分子诊断研讨会将于今年11月8-10日在复旦大学附属中山医院举行。届时,甲基化研究领域于文强、陶谦、娄加陶等专家将在现场作演讲。欢迎您前来参会,聆听大咖智慧,与同行交流观点!
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发