“铜死亡”抗癌最新实例!温州医科大学沈贤/孙维建/俞耀军团队发现抗肿瘤治疗新方法
| 导读 | 诱导铜死亡是一种最新发现的铜依赖的免疫原性细胞死亡方式,是一种很有前景的抗肿瘤治疗方法。 |
3月2日,温州医科大学沈贤/孙维建/俞耀军研究团队在期刊《Advanced Science》上发表了题为“Elesclomol Loaded Copper Oxide Nanoplatform Triggers Cuproptosis to Enhance Antitumor Immunotherapy”的研究论文,本研究结果可为铜死亡介导的抗肿瘤治疗提供一种新策略,可能增强免疫检查点抑制剂治疗的疗效。

https://onlinelibrary.wiley.com/doi/10.1002/advs.202309984
研究背景
01
黑色素瘤是最致命的皮肤癌,起源于黑素细胞的恶性转化。黑色素瘤是全球第五大常见癌症,也是皮肤癌相关死亡的主要原因。该疾病经常转移,并可以通过淋巴结和血管扩散到远处器官,如大脑、肺、肝和骨骼。目前,以程序性细胞死亡-1(PD-1)抗体为代表的免疫检查点抑制剂(ICIs)在临床上对免疫原性黑色素瘤患者显示出良好的治疗效果。尽管其能够大幅增强治疗效果,但目前基于PD-1的免疫治疗由于免疫抑制性肿瘤微环境(TME)和抗肿瘤免疫抑制而受到低响应率的限制。随着黑色素瘤发病率的不断增加,迫切需要提高PD-1治疗的疗效,并开发替代治疗方法,以改善黑色素瘤患者的生存。
铜死亡是一种新型的调控细胞死亡形式,其诱导已成为肿瘤治疗的一项有前景的策略。铜死亡是由细胞内铜离子(Cu2+)的积累引发的,随后与线粒体三羧酸(TCA)循环中的脂氧化组分结合,聚集Cu结合的脂氧化线粒体蛋白,下调Fe-S(铁硫)簇蛋白,导致蛋白毒性应激和最终程序性细胞死亡。铜死亡是一种铜依赖的免疫原性细胞死亡(ICD)形式,涉及通过释放许多损伤相关分子模式(DAMPs)和肿瘤相关抗原的免疫反应。因此,铜死亡可以逆转免疫抑制的TME,并随后增强基于ICI的免疫治疗的疗效。
研究进展
02
免疫抑制因子PD-1是一种增强T细胞杀伤肿瘤细胞的ICI,最近已成为抗肿瘤免疫治疗的热门治疗方法。结果表明,铜死亡诱导纳米系统(ES@CuO)与PD-1联合治疗可能是一种有前途的抗肿瘤治疗策略。研究人员通过建立皮下B16肿瘤荷瘤小鼠,进一步研究了ES@CuO与PD-1联合治疗的抗肿瘤效果。在第5、7和9天,小鼠经静脉注射ES@CuO NPs,腹腔注射PD-1。如图所示,PD-1组的肿瘤生长与PBS组相似,这进一步证实了单独使用PD-1对治疗免疫抑制TME无效。相比之下,ES@CuO+PD-1组小鼠的肿瘤体积明显低于其他治疗组。因此,肿瘤重量数据也显示了类似趋势。随后,研究人员通过苏木精和伊红(H&E)染色证实了ES@CuO+PD-1的治疗效果。同样,与其他组相比,ES@CuO+PD-1组在肿瘤组织中显示了最大面积的坏死细胞。此外,Ki67免疫组化染色定量分析证实了ES@CuO+PD-1治疗的显著肿瘤抑制效果。尤其是,联合治疗组的B16荷瘤小鼠的生存率明显高于其他组。综上所述,这些结果表明ES@CuO可以增强基于PD-1的免疫治疗的抗肿瘤效果。
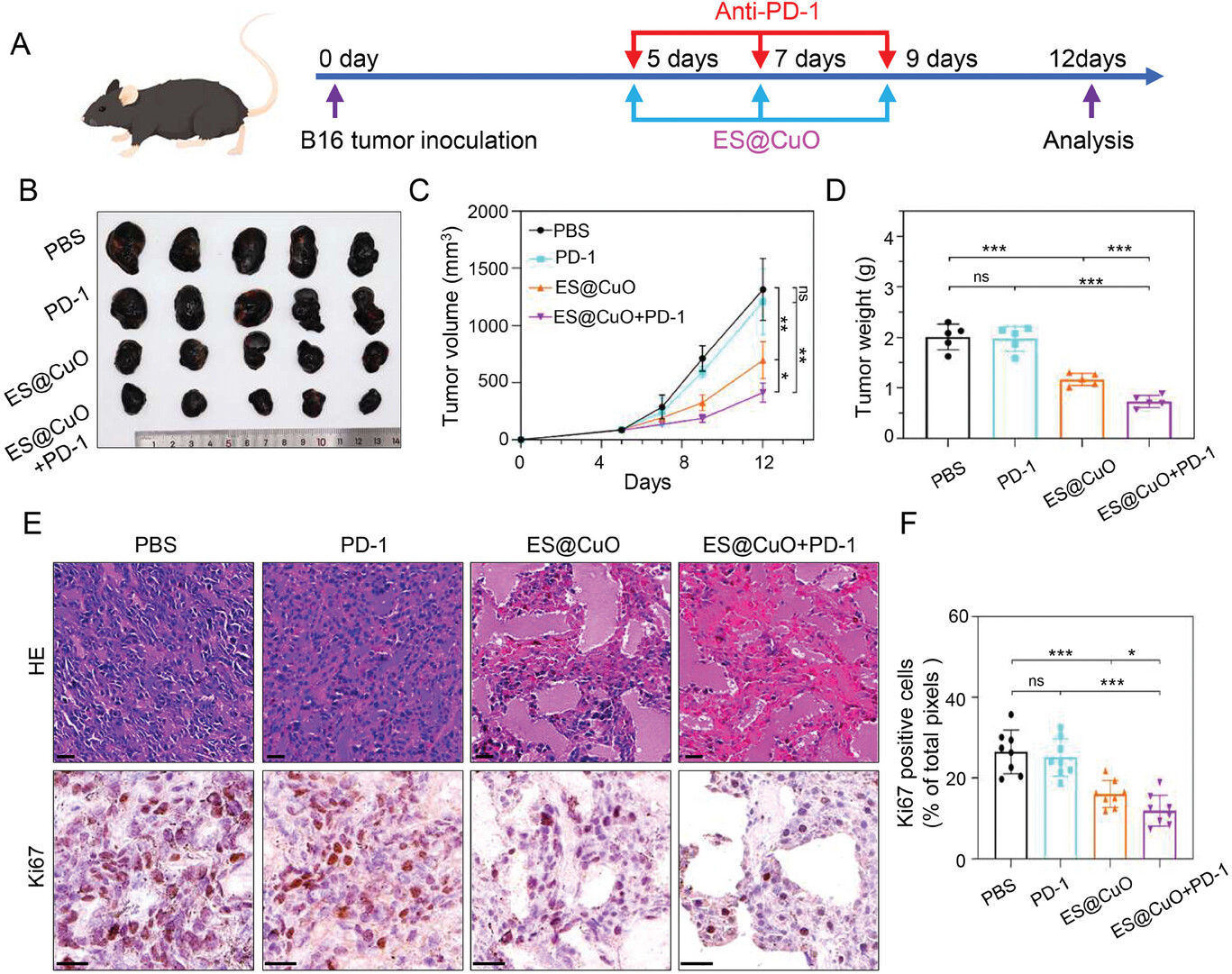
ES@CuO和PD-1联合治疗的体内抗肿瘤效果
研究结论
03
综上,研究人员构建了ES@CuO纳米颗粒作为pH响应药物递送纳米平台,用于Cu2+和ES的协同递送。研究人员通过增强CTLs浸润,ES@CuO和PD-1联合治疗协同重塑了免疫抑制TME,显著抑制了小鼠B16肿瘤的生长。研究结果表明,这些工程纳米平台通过增加ICIs的疗效,为基于铜死亡的抗肿瘤治疗提供了一种有效的范例。(转化医学网360zhyx.com)
参考资料:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202309984
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录


还没有人评论,赶快抢个沙发