LEPR
| 导读 | 概述
LEPR(leptin receptor)为瘦素受体编码基因,由该基因编码的蛋白可以识别和转运瘦素。瘦素是一种和肥胖密切相关的蛋白,可以调节人体的体重、能量代谢和免疫应答等通路,最终导致超重或者肥胖的发生。
国内外的众多研究表明,LEPR基因上的多态现象与血糖、胰岛素、瘦素、甘油三酯水平相关,LEPR基因的缺陷可以直接导致肥胖。
基因结构
LEPR基因位于第一号染色体... |
概述
LEPR(leptin receptor)为瘦素受体编码基因,由该基因编码的蛋白可以识别和转运瘦素。瘦素是一种和肥胖密切相关的蛋白,可以调节人体的体重、能量代谢和免疫应答等通路,最终导致超重或者肥胖的发生。
国内外的众多研究表明,LEPR基因上的多态现象与血糖、胰岛素、瘦素、甘油三酯水平相关,LEPR基因的缺陷可以直接导致肥胖。
基因结构
LEPR基因位于第一号染色体1p31位置,基因全长212.2kb,共有19个外显子,mRNA全长4072nt,编码由1166个氨基酸残基组成的蛋白。
基因分子生物学功能
LEPR基因编码的瘦素受体与瘦素结合,使瘦素发挥调节体内的能量平衡、脂肪贮存等作用,且参与瘦素的自分泌调节以及瘦素的除调节能量外的其他如代谢、生殖、造血等功能。瘦素受体基因的不同剪接可在中枢及外周组织中有选择地表达,瘦素与这些组织中的瘦素受体结合后具有不同的功能。
对中枢的作用
(1) 瘦素可通过类高血糖素肽-1神经元上的瘦素受体L来减少摄食和体重; (2) 瘦素受体在下丘脑几个核团上的表达说明多个神经元的亚型为瘦素作用的靶器官。内阿片-黑素细胞皮质素原( POMC) 基因的产物被认为对进食行为有影响,下丘脑的POMC神经元和POMC基因产物为瘦素发生作用的信号通路中的一部分。
对外周的作用
(1) 肾上腺素有潜在的导致厌食的作用,引起体重下降;(2) 瘦素受体在造血组织中表达,对造血早期及免疫系统的发育起重要作用;(3)瘦素受体大量存在于人的卵巢粒层,卵泡液中存在的瘦素可阻止促黄体激素诱发的雌二醇,提示瘦素对卵巢有直接作用;(4) 通过胎盘及胎儿的软骨、肺等一些组织中的瘦素及瘦素受体基因的表达,瘦素通过旁分泌及内分泌的作用,影响胎儿的生长、发育。
参与食物摄取的神经调控
1998年,Friedman等人[1]在文章中详细地描述了食物摄取的神经调控过程。
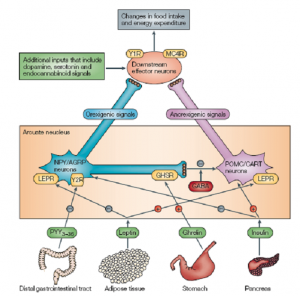
图1 食物摄取的神经调控过程
食物摄取受到由脂肪组织、胃部、胰腺等多个器官分泌的激素调控。其中由脂肪组织分泌的瘦素蛋白在通过外周血进入到中枢神经系统后与瘦素受体蛋白结合,并通过其转运到弓形核细胞内部,激活抑食神经元POMC/CART并抑制促食神经元NPY/AGRP,进而影响更下游的神经冲动,减少食物摄取。
正常情况下,体重的增加和减轻,脂肪的消耗和堆积都会影响瘦素的表达量,并及时反馈到中枢神经系统,对体重的改变及时做出反应,因此可以将体重和脂肪储存量保持在一个相对稳定的范围内。而LEPR基因的突变则可能引起瘦素受体蛋白的结构或者表达量改变,对瘦素蛋白的敏感度下降或者跨膜转运能力下降,从而引起LEPTIN抵抗,削弱或者完全失去了LEPTIN通路对体重调节的能力,导致肥胖的发生。研究证明,当LEPR基因功能发生缺陷的时候,会引发肥胖、糖耐量降低、糖尿病、睡眠呼吸暂停综合症、血脂紊乱、病态性生殖系统异常等疾病。而肥胖等又是很多常见疾病如冠心病、高血压、中风等的危险因素,因此由LEPR参与的肥胖发生发展通路日益受到重视。
此外,Brann等人[2]描述了LEPTIN和LEPR可以通过JAK-STAT通路影响下游的一系列细胞事件,包括细胞周期调控、凋亡、生长增值、免疫调控等,从而一定程度上解释了肥胖病患者罹患癌症的几率要比正常人更高。有研究还认为LEPR上的某些多态与糖耐受向II型糖尿病的转化有关[3];与女性的青春期发育时间也有关系[4]。
参与的通路
如图2所示,JAK-STAT途径目前被认为是瘦素及瘦素受体信号转导的主要途径[5, 6]。瘦素受体本身不具备酪氨酸激酶活性,但它们可通过偶联和激活JAK酪氨酸蛋白激酶家族而实现信号转导。JAK在瘦素激活STAT通路中发挥着中枢作用。当瘦素与其受体结合后可使受体形成二聚体并导致其与JAK的亲和力增强, 并使其结合到配体-受体复合物上,JAK因而聚集,其自身磷酸化位点交互磷酸化, 使其蛋白激酶活化。活化的JAK 激酶使受体胞内结构域内的某些酪氨酸(Tyr) 残基磷酸化,受体通过其Tyr-P 与特定的STAT分子的SH2 结构域相互作用, 使与受体结合的STAT分子的酪氨酸残基磷酸化。可以认为, 磷酸化的受体与磷酸化的JAK的多聚体复合物构成了包括STAT在内的胞浆底物磷酸化的催化剂。STAT 分子具有SH2和SH3结构域,C端有一个保守的酪氨酸残基,酪氨酸磷酸化对STAT 的活化十分重要。被JAK磷酸化的STAT分子可通过Tyr-P 和SH2 结构域形成二聚体,并从受体复合物中解离。此二聚体可穿过核膜转位到细胞核内,与靶基因上游的反向重复序列TTCCNGGAA 结合,启动特定基因的表达,转录并翻译特定蛋白,从而发挥瘦素的生物学效应。

图2 JAK-STAT信号通路
如图3所示,骨骼肌内的瘦素信号通路被激活后,将启动AMP活化蛋白激酶(AMPK)。AMPK在营养物质代谢的过程中起着非常关键的作用。AMPK使乙酰辅酶A羧化酶(ACC)被磷酸化从而失活。ACC的作用是催化乙酰辅酶A生成丙二酰辅酶A(malonyl-CoA)。丙二酰辅酶A可以抑制肉碱棕榈酰基转移酶I,从而阻止脂肪酸进入线粒体进行氧化而产生热能。当有瘦素存在时,AMPK被激活,ACC受到抑制,丙二酰辅酶A的生成减少,增加脂肪酸的氧化,降低细胞内的脂质含量。[7]
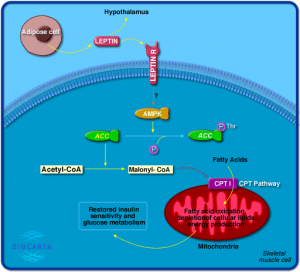
图3 瘦素及瘦素受体的信号通路
LEPR(leptin receptor)为瘦素受体编码基因,由该基因编码的蛋白可以识别和转运瘦素。瘦素是一种和肥胖密切相关的蛋白,可以调节人体的体重、能量代谢和免疫应答等通路,最终导致超重或者肥胖的发生。
国内外的众多研究表明,LEPR基因上的多态现象与血糖、胰岛素、瘦素、甘油三酯水平相关,LEPR基因的缺陷可以直接导致肥胖。
基因结构
LEPR基因位于第一号染色体1p31位置,基因全长212.2kb,共有19个外显子,mRNA全长4072nt,编码由1166个氨基酸残基组成的蛋白。
基因分子生物学功能
LEPR基因编码的瘦素受体与瘦素结合,使瘦素发挥调节体内的能量平衡、脂肪贮存等作用,且参与瘦素的自分泌调节以及瘦素的除调节能量外的其他如代谢、生殖、造血等功能。瘦素受体基因的不同剪接可在中枢及外周组织中有选择地表达,瘦素与这些组织中的瘦素受体结合后具有不同的功能。
对中枢的作用
(1) 瘦素可通过类高血糖素肽-1神经元上的瘦素受体L来减少摄食和体重; (2) 瘦素受体在下丘脑几个核团上的表达说明多个神经元的亚型为瘦素作用的靶器官。内阿片-黑素细胞皮质素原( POMC) 基因的产物被认为对进食行为有影响,下丘脑的POMC神经元和POMC基因产物为瘦素发生作用的信号通路中的一部分。
对外周的作用
(1) 肾上腺素有潜在的导致厌食的作用,引起体重下降;(2) 瘦素受体在造血组织中表达,对造血早期及免疫系统的发育起重要作用;(3)瘦素受体大量存在于人的卵巢粒层,卵泡液中存在的瘦素可阻止促黄体激素诱发的雌二醇,提示瘦素对卵巢有直接作用;(4) 通过胎盘及胎儿的软骨、肺等一些组织中的瘦素及瘦素受体基因的表达,瘦素通过旁分泌及内分泌的作用,影响胎儿的生长、发育。
参与食物摄取的神经调控
1998年,Friedman等人[1]在文章中详细地描述了食物摄取的神经调控过程。

图1 食物摄取的神经调控过程
食物摄取受到由脂肪组织、胃部、胰腺等多个器官分泌的激素调控。其中由脂肪组织分泌的瘦素蛋白在通过外周血进入到中枢神经系统后与瘦素受体蛋白结合,并通过其转运到弓形核细胞内部,激活抑食神经元POMC/CART并抑制促食神经元NPY/AGRP,进而影响更下游的神经冲动,减少食物摄取。
正常情况下,体重的增加和减轻,脂肪的消耗和堆积都会影响瘦素的表达量,并及时反馈到中枢神经系统,对体重的改变及时做出反应,因此可以将体重和脂肪储存量保持在一个相对稳定的范围内。而LEPR基因的突变则可能引起瘦素受体蛋白的结构或者表达量改变,对瘦素蛋白的敏感度下降或者跨膜转运能力下降,从而引起LEPTIN抵抗,削弱或者完全失去了LEPTIN通路对体重调节的能力,导致肥胖的发生。研究证明,当LEPR基因功能发生缺陷的时候,会引发肥胖、糖耐量降低、糖尿病、睡眠呼吸暂停综合症、血脂紊乱、病态性生殖系统异常等疾病。而肥胖等又是很多常见疾病如冠心病、高血压、中风等的危险因素,因此由LEPR参与的肥胖发生发展通路日益受到重视。
此外,Brann等人[2]描述了LEPTIN和LEPR可以通过JAK-STAT通路影响下游的一系列细胞事件,包括细胞周期调控、凋亡、生长增值、免疫调控等,从而一定程度上解释了肥胖病患者罹患癌症的几率要比正常人更高。有研究还认为LEPR上的某些多态与糖耐受向II型糖尿病的转化有关[3];与女性的青春期发育时间也有关系[4]。
参与的通路
如图2所示,JAK-STAT途径目前被认为是瘦素及瘦素受体信号转导的主要途径[5, 6]。瘦素受体本身不具备酪氨酸激酶活性,但它们可通过偶联和激活JAK酪氨酸蛋白激酶家族而实现信号转导。JAK在瘦素激活STAT通路中发挥着中枢作用。当瘦素与其受体结合后可使受体形成二聚体并导致其与JAK的亲和力增强, 并使其结合到配体-受体复合物上,JAK因而聚集,其自身磷酸化位点交互磷酸化, 使其蛋白激酶活化。活化的JAK 激酶使受体胞内结构域内的某些酪氨酸(Tyr) 残基磷酸化,受体通过其Tyr-P 与特定的STAT分子的SH2 结构域相互作用, 使与受体结合的STAT分子的酪氨酸残基磷酸化。可以认为, 磷酸化的受体与磷酸化的JAK的多聚体复合物构成了包括STAT在内的胞浆底物磷酸化的催化剂。STAT 分子具有SH2和SH3结构域,C端有一个保守的酪氨酸残基,酪氨酸磷酸化对STAT 的活化十分重要。被JAK磷酸化的STAT分子可通过Tyr-P 和SH2 结构域形成二聚体,并从受体复合物中解离。此二聚体可穿过核膜转位到细胞核内,与靶基因上游的反向重复序列TTCCNGGAA 结合,启动特定基因的表达,转录并翻译特定蛋白,从而发挥瘦素的生物学效应。

图2 JAK-STAT信号通路
如图3所示,骨骼肌内的瘦素信号通路被激活后,将启动AMP活化蛋白激酶(AMPK)。AMPK在营养物质代谢的过程中起着非常关键的作用。AMPK使乙酰辅酶A羧化酶(ACC)被磷酸化从而失活。ACC的作用是催化乙酰辅酶A生成丙二酰辅酶A(malonyl-CoA)。丙二酰辅酶A可以抑制肉碱棕榈酰基转移酶I,从而阻止脂肪酸进入线粒体进行氧化而产生热能。当有瘦素存在时,AMPK被激活,ACC受到抑制,丙二酰辅酶A的生成减少,增加脂肪酸的氧化,降低细胞内的脂质含量。[7]

图3 瘦素及瘦素受体的信号通路
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发