全球生物类似药市场巨大,我国紧跟步伐颁布《指导原则》
| 导读 | 有机构大胆预测,到2017年,生物类似药市场的潜在规模为1670亿美元。目前为止,全球已有多个国家和地区出台了生物类似物的相关指南。3月3日,CFDA紧跟全球步伐,发布《生物类似药研发与评价技术指导原则(试行)》,填补了国内生物类似物法规的空白。 |
日前, CPHI第五届中国仿制药峰会2015在上海隆重召开,会议集合了数百位仿制药行业的科研、政府与产业代表,以“仿制药审评与合规”和“伴随技术更新的仿制药市场战略分析”两大主题,探讨和交流了仿制药行业的最新法规、技术和资讯。
全球生物类似药市场巨大
近年来,全球生物药物产业迅猛发展,市场规模不断扩大。2013年,全球生物药物的市场规模达1570亿美元,与2012年(1500亿美元)比上涨了4.7%。在我国,2013年生物药物市场规模约2100亿元,与2012年(1820亿元)比增长率高达14%。
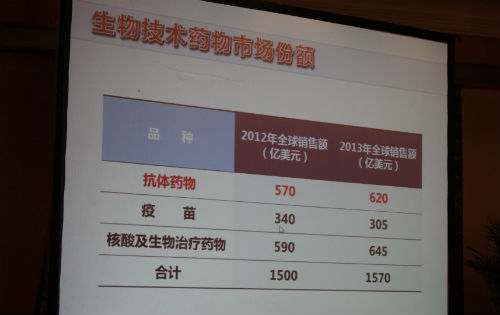
单抗药物为代表,疫苗、生物治疗类药物(包括核酸药物、细胞治疗、基因治疗)已成为生物药销售贡献的重要组成部分。其中,2012年抗体药物的销售额为570亿美元,2013年增长至620亿美元;2012年疫苗的销售额为340亿美元,2013年降至305亿美元。
生物药是一类新型的药物,来自于活细胞,不能完全精确地被仿制,因此生物药的仿制药被称为“生物类似物”(biosimilar)。随着生物药专利不断到期,生物类似物市场显示出了强劲的发展潜力。
据生物医药领域世界著名咨询公司IMS预测,到2015年全球生物类似物市场会达到19~37亿美元的规模。F&S市场调查公司预测生物类似药市场2019年将达到230亿美元。英国市场研究机构Companies and markets调查报告更是大胆预测,到2017年,生物类似药市场的潜在规模为1670亿美元。
对于生物类似物,FDA设置了比常规化学仿制药更高的准入门槛。因为生产上的差异,FDA要求开展一些规定的临床试验以确保生物类似物和原研药的作用机制相同。尽管有着严格的要求,但从近日FDA批准了首款生物类似药来看,美国政府一直在关注生物类似药的发展。
紧跟步伐:我国颁布生物类似药政策
由于生物类似药与传统意义上的仿制药不同,很难做到跟原研药一模一样。随着全球生物类似物的研发不断增多,关于此类药物的研发与评价技术要求受到国内外制药业、各国药品监管当局以及国际社会和组织的广泛关注。到目前为止,全球已有多个国家和地区出台了生物类似物的相关指南。
2010年美国国会通过了一项法案。根据该法案,所开发的生物类似物可以被允许在美国销售。在欧盟,2006年就通过了相关法律,2008年安进Neupogen的生物类似物已经开始销售。

今年3月3日,为指导和规范生物类似药的研发与评价工作,推动生物医药行业健康发展,国家食品药品监督管理总局发布《生物类似药研发与评价技术指导原则(试行)》(以下简称,指导原则),对生物类似药的申报程序、注册类别和申报资料等相关注册要求进行了规范。该《指导原则》的出台填补了国内生物类似物法规的空白,有利于加速生物类似物研发上市进度。
由于目前在售的原研药价格过高,很多都超出了患者能够承受的范围。此外,生物药行业正处于发展初期的“混沌状态”,随着从事生物药研发的企业数量不断增加,急需法规对行业发展进行规范。在《指导原则》制定的过程中,国家相关部门多次召开座谈会,发布征求意见稿,充分听取业内人士的意见,真正做到的了开门立法。
在此次会议中,嘉和生物战略合作副总裁陈如雷对该《指导原则》谈了他的看法。他表示,该《指导原则》与欧美、WHO的原则要求基本一致,既具有规范性,也具有灵活性;在一些具体内容上,充分回应了业界研发实践的具体诉求。
未来发展
随着生物药在整个药品行业比重的不断增加,生物类似药也逐渐成为了医药领域的新力量。统计数据表明,2011年之后最畅销的生物药专利将逐步到期,市值预计将达到1600亿美元。
不过也有人认为,生物类似药上市进程可能会很慢,预计再过10年才会比较顺畅。在临床使用上,不少医生对生物类似药的安全性和有效性仍然持怀疑态度,许多相关人员对生物类似药的概念仍然模糊不清。因此,未来生物仿制药市场是否真能像预测数据体现的那般美好,也只能能让时间来证明了。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发