质谱流式技术在TIL研究中的应用
| 导读 | 免疫细胞经常会出现在肿瘤组织中。它们也被称为肿瘤浸润性白细胞(Tumor Infiltrating Leukocyte)。这些细胞组成复杂、多变,在肿瘤发生过程中发挥着巨大的作用。目前已经成为了肿瘤免疫治疗领域研究的热点。 |
免疫细胞经常会出现在肿瘤组织中。它们也被称为肿瘤浸润性白细胞(Tumor Infiltrating Leukocyte)。这些细胞组成复杂、多变,在肿瘤发生过程中发挥着巨大的作用。目前已经成为了肿瘤免疫治疗领域研究的热点。
由于免疫细胞的异质性,需要对其进行单细胞分析才能获得真实、全面的信息。单细胞测序技术解决了单细胞的大规模核酸检测问题,使科学家可以从基因和转录水平深入研究异质性的免疫细胞。同时,质谱流式技术(Mass Cytometry)的出现,将蛋白水平的单细胞分析推向了一个新的高度。

这样的分析,对质谱流式技术而言,只算“牛刀小试”,远没有达到它的能力极限。研究人员完全可以利用其他标签标记更多的Marker或者胞内蛋白,去研究更精细的亚群及其功能。目前,质谱流式的生产商(Fluidigm)总共提供37种不同抗体的标签,即可以支持37种蛋白的同时检测;在全球各地质谱流式实验室中,已经有人实现了50多种抗体的同时检测;而质谱流式仪本身的极限是“逆天”的135个!虽然我们未必能把这些通道全部用上,但显而易见,未来它还有广阔的发展空间。
值得一提的是,该研究中仅使用了17个表面Marker,所以未来可以对肿瘤进行更加精细的亚群和功能分析。
由于可以同时使用几十种带有不同标签的抗体同时标记切片,我们可以得到同一视野下几十种蛋白的定位图像信息。根据一些膜蛋白的定位信息,计算机可以在图片上识别出每个细胞的边界,进而分析视野里每个细胞中各个蛋白的表达数据,据此可以对这些细胞进行亚群分析。

目前,成像质谱流式所用到的激光剥蚀模块还没有正式的产品,未来它将做为一个质谱流式的升级模块推出。
(转化医学网360zhyx.com)
由于免疫细胞的异质性,需要对其进行单细胞分析才能获得真实、全面的信息。单细胞测序技术解决了单细胞的大规模核酸检测问题,使科学家可以从基因和转录水平深入研究异质性的免疫细胞。同时,质谱流式技术(Mass Cytometry)的出现,将蛋白水平的单细胞分析推向了一个新的高度。

质谱流式的原理
(利用带有金属标签的抗体标记细胞,ICP-Mass做为检测手段,质谱流式实现了几十个通道的单细胞检测,同时也最大程度避免了通道间的信号干扰)
在短短的1秒钟内,一台Helios质谱流式仪能够检测上千个单细胞中几十个蛋白的表达数据。这种强大的数据获取能力使可以在能免疫细胞分析方面大显身手。我们知道,免疫细胞上有众多的CD分子可以做为亚群分类的标志物,而细胞内更有大量的信号通路蛋白、转录因子、细胞因子等直接反映了细胞的功能。设想一下,如果可以根据自己的研究方向,在单细胞水平把自己感兴趣的蛋白一起检测,这是多么令人振奋的想法!
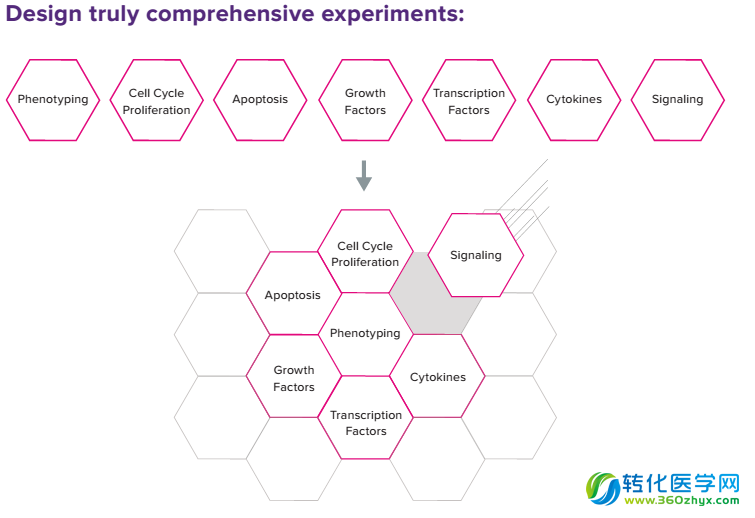
质谱流式可以帮助研究者实现复杂的实验设计
以CD4+T为例,它们历来以“变化多端”著称,按照其成熟状态可以分为Na?ve、TCM 、TEM、Effector T;如果按照功能分,CD4+T中含有Th1、Th2、Th17、Th22以及各种状态的Treg亚群等等;随着研究的不断深入,还不断有新的功能亚群被识别,而且这些亚群内部依然存在很大的异质性。CD8+ T细胞情况也很与此类似。对此,有研究人员尝试用质谱流式分析了人的外周血样本,在这个实验中他们检测了26个表面Marker,结果……,好吧,还是先上图吧。
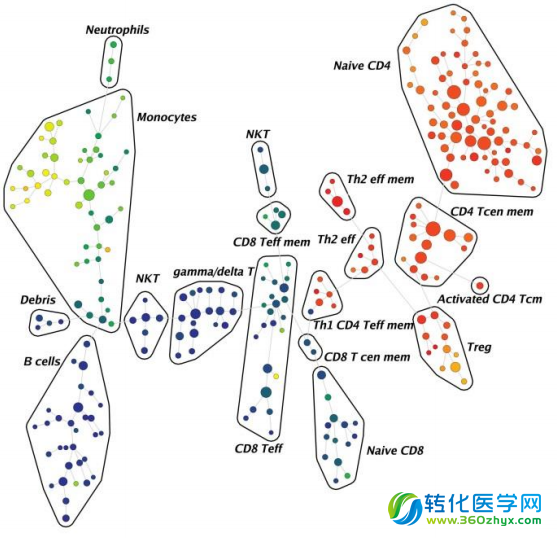
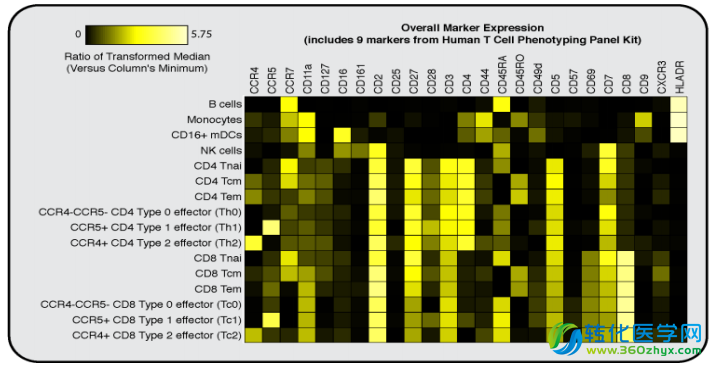
质谱流式对PBMC内T细胞亚群的精细分析
起初看到这幅图,多少有一点“眼晕”--没错,T细胞的组成就是这么复杂。左边的树形图其实叫做SPADE分析,是一种基于生物信息学的亚群分析方法。图中一个个不规则的“大圈圈”就是质谱流式识别出的T细胞亚群,“大圈圈”里面繁多的彩色圆点其实是具有由表型形似的细胞组成的更小亚群。右边的方格状的小图是在展示不同亚群里各个Marker的表达情况。这样的分析,对质谱流式技术而言,只算“牛刀小试”,远没有达到它的能力极限。研究人员完全可以利用其他标签标记更多的Marker或者胞内蛋白,去研究更精细的亚群及其功能。目前,质谱流式的生产商(Fluidigm)总共提供37种不同抗体的标签,即可以支持37种蛋白的同时检测;在全球各地质谱流式实验室中,已经有人实现了50多种抗体的同时检测;而质谱流式仪本身的极限是“逆天”的135个!虽然我们未必能把这些通道全部用上,但显而易见,未来它还有广阔的发展空间。
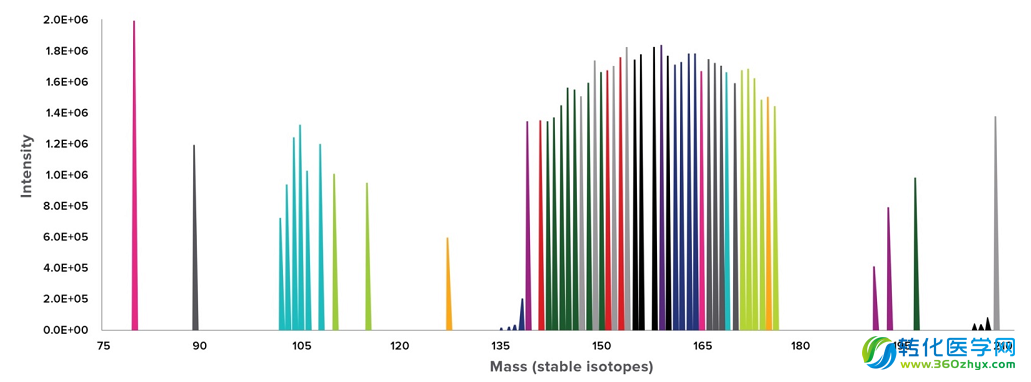
Helios质谱流式仪具有很宽的检测范围(75~210道尔顿)
(图中的信号峰代表已经开发出相应的元素标签,空白的位置还有待新的元素标签填上)
回到肿瘤浸润性白细胞,我们简单的看一看下面的研究实例便可以了解未来该技术在该领域的潜力。这是一个由美国德克萨斯大学、中国中山大学等多个研究单位进行的一项跨国合作科研项目。其部分研究成果发表在2015年底的《Cancer Discovery》杂志上。在此研究中,研究者利用质谱流式分析了小鼠模型上肿瘤组织的细胞组成:

质谱流式对小鼠肿瘤进行的亚群分析
(注释: Mφ:巨噬细胞;MDSCs:骨髓来源的抑制性细胞;Dendritic :树突状细胞;Nonimmune TME:免疫细胞以外的肿瘤微环境细胞;PCa Cells是指肿瘤细胞。左大图展示各个亚群,右面展示不同Marker的表达情况 )
如上图所示,研究者将肿瘤组织分为了数个不同的亚群,这些亚群包括肿瘤细胞和各类免疫细胞在内。通过一系列对比分析,研究人员发现MDSC细胞比例在肿瘤发生过程中比例会逐渐增大,在14周的小鼠体内MDSC已经成为主要的免疫细胞亚群,占比达58%。这提示MDSC在这种肿瘤发生过程中具有重要的作用,随后实验数据也证明了这一点。值得一提的是,该研究中仅使用了17个表面Marker,所以未来可以对肿瘤进行更加精细的亚群和功能分析。
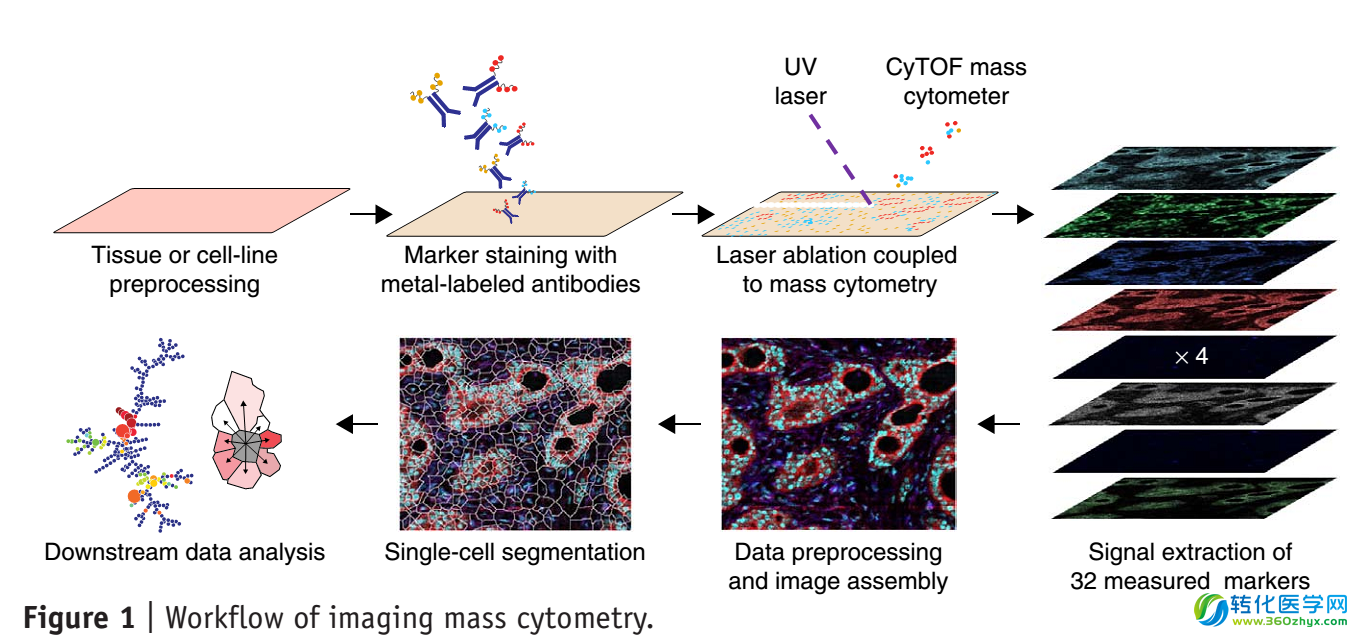
近两年,质谱流式又迎来了一次技术飞跃,将为肿瘤免疫领域的研究产生深远的影响,这就是成像质谱流式(Imaging Mass Cytometry)的诞生。所谓成像质谱流式,就是给质谱流式加上一个激光剥蚀模块,使其具有组织成像功能,具体的工作原理如下:

成像质谱流式技术流程及其获得的乳腺癌组织图片
用金属标签抗体对组织切片进行标记,然后利用激光剥蚀系统对其进行逐点扫描,激光照射会使标签金属元素挥发,氩气流会将其带入质谱流式仪中进行检测。得到每个点的金属含量后,计算机就可以重构出细胞的影像。由于可以同时使用几十种带有不同标签的抗体同时标记切片,我们可以得到同一视野下几十种蛋白的定位图像信息。根据一些膜蛋白的定位信息,计算机可以在图片上识别出每个细胞的边界,进而分析视野里每个细胞中各个蛋白的表达数据,据此可以对这些细胞进行亚群分析。

成像质谱流式对乳腺癌组织的单细胞分析(红色标记的CD20是B细胞Marker)
这样,我们可以识别出肿瘤组织中的免疫细胞,并且知道它属于什么亚群,同时也知道它在组织中的位置,周围有哪些细胞与之相护作用。这种定位信息和分类信息的同时获得,在研究肿瘤微环境、肿瘤免疫的精细机制等等领域具有非常重要的意义。目前,成像质谱流式所用到的激光剥蚀模块还没有正式的产品,未来它将做为一个质谱流式的升级模块推出。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发