遗传发育所揭示黑色素瘤转移机制
| 导读 | 上皮间质转化(Epithelial Mesenchymal Transition,EMT)描述了上皮来源的细胞通过特定程序转变成间充质样细胞的过程。EMT的发生是肿瘤转移的重要过程。恶性黑色素瘤是起源于黑色素细胞的一种恶性肿瘤,虽然并非上皮肿瘤,其发展过程中表现出很多类似EMT的特征。TET(Ten Eleven Translocation)蛋白家族是一类DNA主动去甲基化酶,从良性的黑痣发生癌变并逐步恶化的过程中,TET基因家族表达水平逐渐下调,但TET蛋白家族是否调控黑色素瘤类EMT过程的发生并不明确。5hmC水平和TET基因表达水平可能成为一个区分良性黑痣和恶性黑色素瘤的分子标志。 |
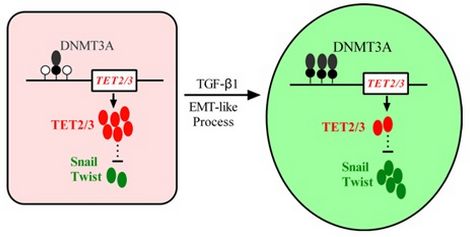
TGF-β诱导TET2和TET3基因发生甲基化而沉默与发生类EMT过程模型
上皮间质转化(Epithelial Mesenchymal Transition,EMT)描述了上皮来源的细胞通过特定程序转变成间充质样细胞的过程。EMT的发生是肿瘤转移的重要过程。恶性黑色素瘤是起源于黑色素细胞的一种恶性肿瘤,虽然并非上皮肿瘤,其发展过程中表现出很多类似EMT的特征。TET(Ten Eleven Translocation)蛋白家族是一类DNA主动去甲基化酶,从良性的黑痣发生癌变并逐步恶化的过程中,TET基因家族表达水平逐渐下调,但TET蛋白家族是否调控黑色素瘤类EMT过程的发生并不明确。5hmC水平和TET基因表达水平可能成为一个区分良性黑痣和恶性黑色素瘤的分子标志。
中国科学院遗传与发育生物学研究所马润林研究组发现,在TGF-β1诱导黑色素瘤细胞发生类EMT的过程中,TET2基因和TET3基因在mRNA和蛋白水平均发生表达下调;在不同来源的黑色素瘤细胞系和肿瘤组织中,TET2基因表达水平与EMT标志基因表达水平具有相关性;敲降TET2或TET3基因即能诱导细胞发生类似EMT的现象,同时多个调控EMT的转录因子表达被激活;DNA甲基化抑制剂处理能逆转TGF-β1对TET2/3的抑制作用,敲降DNMT3A基因也能激活TET2和TET3的表达;ChIP-PCR实验也发现,TGF-β1处理促进了DNMT3A与TET2和TET3基因启动子区的结合,故TGF-β1能通过激活TET2和TET3基因启动子区发生甲基化来抑制其表达。另外,在体外实验中过表达TET2基因能够部分逆转TGF-β1所诱导的类EMT过程;在小鼠模型中,过表达TET2基因也对肿瘤的生长和转移有所抑制。
该研究揭示TET2和TET3基因的甲基化修饰是黑色素瘤发生类EMT过程和转移的一个重要过程,为黑色素瘤的发展提供了一个新的表观遗传学解释。
上述研究成果于11月12日在线发表于Oncotarget杂志(DOI: 10.18632/oncotarget.13324)。马润林研究组的博士研究生巩福星为该论文的第一作者,马润林为通讯作者。该研究得到了国家自然科学基金委和“973”计划等项目的资助。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发