肿瘤早期诊断新靶标之ctDNA
| 导读 | 肿瘤液态活检是目前最具发展潜力的肿瘤无创诊断和实时疗效监测手段,区别于传统的临床诊断手段,该方法具有简便、安全、无创、实时等特点。广义而言,肿瘤液态活检主要是指以外周血液为主的体液标本中细胞及核酸的检测。通常包括了循环肿瘤细胞(CTC)和游离的DNA(ctDNA)两大类,是目前精准医疗的最前沿领域之一,临床应用价值极其显著,在肿瘤的诊疗领域具有良好的应用前景。 |
1.外周血游离DNA(Circulating tumor DNA, ctDNA)介绍
临床上很大一部分被诊断为癌症的患者可以仅依靠手术和辅助治疗手段缓解病症,但是经过一段时间的潜伏期后会有超过80%的癌症患者死于肿瘤细胞的转移和复发。原因在于经过初步的治疗后由于肿瘤细胞的暂时性休眠,其可以在这种状态下传播到其他组织器官中,而在这个过程中,肿瘤细胞会发生一系列的表观改变,如EMT过程,从而使其逃避免疫监测和对药物发生耐药,进而实现转移。肿瘤细胞的逃逸无疑给临床治疗造成了很大的困扰,因此,很多医生和临床科研人员都希望有一种快捷、精确的技术方法能够有效地克服该难题,而循环DNA无疑就是辅助治疗的有效方法之一。血浆中游离循环肿瘤DNA(Circulating Tumor DNA, ctDNA)是由肿瘤细胞释放到血浆中的单链或者双链DNA,携带有与原发肿瘤组织相一致的分子遗传学信息。
早在1947年Mandel和Metais就发现了循环核酸;随后Leon等人的研究结果表明肿瘤患者外周血清DNA水平大大高于正常人,之后的研究者在肿瘤患者的血浆和血清中检测到了癌基因突变,并且与原发肿瘤相一致。2013年《The New England Journal of Medicine, NEJM》研究结果发现:ctDNA检测作为一种无创的检测方法,能够真实的反映实体瘤组织中的基因突变图谱与频率,是治疗效果的评估及治疗后临床随访的重要监测指标。ctDNA来自肿瘤细胞凋亡或坏死后进入循环系统的DNA片段,其保留了较为完整的基因信息(如图1)。因此,ctDNA是一种特征性的肿瘤生物标记物,并且还可以被定性、定量和追踪。
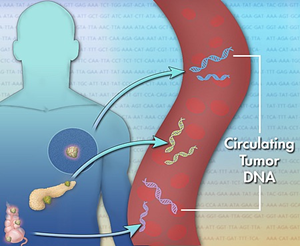
一直以来,科研工作者都在积极寻找能够更好地反映肿瘤情况的生物标志物。ctDNA作为一种新的肿瘤标志物,在对肿瘤的早期诊断、治疗及预后检测等方面发挥着重要的作用,尤其是对于一些不具有典型临床症状、检查无特异性和诊断困难的肿瘤,检测ctDNA可避免复杂的、具有创伤性的活检。
在临床工作中,通过检测它是否携带有肿瘤特异性的突变,或其它相关基因组的改变信息就可以判断肿瘤类型,而不会出现假阳性等干扰现象。常用ctDNA的检测分析方法包括定量PCR,微滴数字式PCR(Droplet Digital PCR, ddPCR),BEAMing(beads, emulsion, amplification, magnetics),以及NGS相关的标记扩增深度测序方法(Tagged-amplicon deep sequencing, TAm-seq),全基因组测序,全外显子测序等。可以对ctDNA进行定性分析,检测基因突变、缺失、插入、融合、重排和杂合性缺失(LOH)等;也可以对ctDNA浓度进行定量分析,定性和定量两种方法均可以反映肿瘤的存在和严重程度。
2.外周血游离DNA(Circulating tumor DNA, ctDNA)临床应用
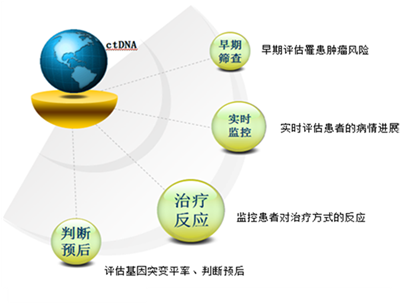
肿瘤患者血液循环系统中含有随着血液不断流动的携带一定特征的来自肿瘤基因组的DNA片段。这些DNA片段主要来源于四个部分:1、坏死的肿瘤细胞释放的DNA片段;2、凋亡的肿瘤细胞释放的DNA片段;3、循环肿瘤细胞释放的DNA片段;4、肿瘤细胞分泌的外排体包含的DNA片段。自人类首次发现ctDNA以来,对其的研究就从未中断过。在1994年,研究人员首次鉴定了来源于肿瘤的含有癌症标志性突变的DNA。加上ctDNA的无创性和易获得性,在其中发现的肿瘤标志物,被认为可以用于肿瘤诊断的各个过程(如图2)。
Bettegowda报道了一篇文章,称ctDNA水平在早期和晚期肿瘤中存在差异。研究人员发现,在640例患者中,ctDNA可检测超过75%的晚期胰腺癌、卵巢癌、结直肠癌、膀胱癌、胃癌、乳腺癌、黑色素瘤、肝癌,以及头颈癌。此外,在206例转移性结直肠癌患者中,源自KRAS基因突变的ctDNA具有87.2%的敏感性和99.2%的异质性。研究人员还发现,96%的表皮生长因子受体被抑制后复发的患者体内有ctDNA,这就表明在丝裂原活化蛋白激酶途径中发生了单基因或多基因突变。《Science Translational Medicine》发表的一项多样本的研究报告中显示可以在大约40%至70%的癌症中检测到循环肿瘤DNA,包括脑瘤、前列腺癌,根据多项研究结果我们可以看出ctDNA在绝大多数肿瘤疾病中均有发生,对肿瘤的发生具有重要提示作用。
目前随着二代测序技术NGS的不断发展,对ctDNA的监测分析已越来越多地应用于各种肿瘤的检测之中,诸如对非小细胞肺癌、乳腺癌和胰腺癌等。在过去十年中,对非小细胞肺癌的理解发生了重要的变化。现在医生认为,针对NSCLC的个性化治疗,应该是利用这些分子亚型匹配相对应的靶向疗法。表皮生长因子(EGFR)突变和ALK易位被认为是NSCLC治疗最有效的靶点。但是EGFR和ALK的突变数量是多种多样的,并且我们检测到的突变类型还在不断地增加。因此,现代科学家们利用基于NGS的ctDNA技术,从患者血液中可以获得ROS1,BRAF,KRAS,HER2,PIK3CA等相关基因的突变信息,从而根据基因突变情况选择合适的基因药物,有针对性的进行靶向治疗。乳腺癌转移确诊后,患者生存率较低。但是现在可以利用含有肿瘤染色体异质性的ctDNA来对乳腺癌进行检测。一项临床研究通过NGS方法能够覆盖很多低信号的全基因组测序结果,并且发现ctDNA监测是高度精确的,其成功预示了93%的复发病人。因此,ctDNA能够预测不良生存期。这些发现表明,我们可以利用ctDNA检测肿瘤细胞转移情况,开展有针对性的治疗。在Eric A教授的关于胰腺癌的研究中,他们分析了26名患者肿瘤中的54个基因,其中90.3%的肿瘤突变都能够在ctDNA中发现,其正确率为97.7%,灵敏度为92.3%,特异性为100%。同时,他们发现,ctDNA与肿瘤标记动态是具有相关性的。因此,可以在胰腺癌和胆道癌患者中,通过ctDNA测序的方法,来确定患者的肿瘤基因型,从而为患者提供精准的个体化治疗。
综上所述,ctDNA因其分布具有广泛性,且与来源组织基因保持高度的一致性,已经在临床上获得了越来越多的重视,在早期患病评估、病程监测、治疗反应以及预后判断等方面均已开展相关的应用尝试且获得了较为满意的结果。
3.展望
ctDNA作为一种新的肿瘤标志物,其在肿瘤的诊断、治疗及预后检测等方面逐渐发挥出重要的作用,尤其是对于一些不具有典型临床症状、检查无特异性和诊断困难的肿瘤可避免复杂的、具有创伤性的活检。正如Forshew所说:循环肿瘤标志物的前景是巨大的,因为其代表了最前沿的无创检测技术,具有高度敏感性和特异性,对临床辅助诊断具有高度的可信性。随着肿瘤分子生物学研究的进展,血浆游离循环肿瘤DNA检测技术必将成为临床肿瘤早期诊断、预后判断、跟踪随访等的一项重要的分子生物学检测手段。
但是在目前ctDNA依然存在着一些需要克服的难题。由于巨噬细胞的清除作用,通常体液中游离核酸(cfDNA)会被实时清除而导致含量极低,并且会被进入循环系统的健康DNA所掩盖,从而难以检出。不同肿瘤的敏感度差异大。具文献报道,在640位14种肿瘤患者中只有不到50%的髓母细胞瘤、甲状腺癌,以及不到10%的胶质瘤患者可以检测到ctDNA。还有,目前ctDNA尚处于小范围内测试,而且临床检测费用昂贵,导致很多病患负担不起,这也是制约该项技术大规模推广的原因之一。其次,ctDNA技术属于新兴的无创检测技术,尚需不断地优化完善,并没有标准化。与其他高通量测序技术的临床转化一样,ctDNA的临床诊断和治疗在大规模推广前需要对其进行标准化。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发