肺癌靶向治疗:从一枝独秀到百花齐放
| 导读 | 科罗拉多大学的Hirscl教授2016在《The Lancet》上发表了综述文章《New and emerging targeted treatments in advanced non-small-cell lung cancer》对晚期非小细胞肺癌(NSCLC)的靶向治疗进行了系统性回顾总结。 |
科罗拉多大学的Hirscl教授2016在《The Lancet》上发表了综述文章《New and emerging targeted treatments in advanced non-small-cell lung cancer》对晚期非小细胞肺癌(NSCLC)的靶向治疗进行了系统性回顾总结。
第一代EGFR-TKI——Gefitinib的获批上市,为肺癌开启了分子靶向治疗的新征程。EGFR-TKI针对EGFR突变亚型患者所表现的高治疗应答率证实了靶基因变异状态对靶向药物疗效的预测作用。另一方面,研究者不断探寻更多肺癌其他驱动基因,并陆续发现了ALK融合、HER2及BRAF突变、MET跳跃突变、以及ROS1、RET等其它基因变异,相应的靶向药物也不断涌现,甚至对于EGFR突变及ALK融合型肺癌,能够克服继发耐药的二代乃至三代的TKI药物都已出现。近十年肺癌治疗已进入靶向治疗时代,并从最初的一代EGFR-TKI一枝独秀迎来如今二代、三代TKI以及越来越多其他靶基因抑制剂百花齐放!
许多大型III期临床试验均已证实在EGFR突变阳性的NSCLC患者的一线治疗中,EGFR-TKI和化疗相比表现出更显著的疗效、更低的毒副作用及更优异的生存质量。因此,几乎所有的指南均推荐EGFR-TKI(如gefitinib、erlotinib或afatinib)作为EGFR突变阳性患者的一线治疗方案。
不同的EGFR-TKI针对不同的EGFR突变类型表现出不同的治疗反应差异。如相比EGFR 21外显子L858R突变,二代EGFR-TKI afatinib针对EGFR 19外显子缺失突变患者的OS延长作用更为明显。同时LUX-Lung 7结果也提示afatinib相较gefitinib可明显延长患者的PFS,但OS无显著差异。因此对靶向药物的选择应综合考虑EGFR不同位点突变类型,以及患者的体力状态、治疗便利性及不良反应等(如肝毒性更常见于gefitinib;而腹泻和皮肤毒性更常见于afatinib)。EGFR 20外显子插入突变的NSCLC患者对目前所有临床获批的EGFR-TKI均不敏感,但已经有一种新药EGF816在实验模型上表现出了治疗有效性。
尽管部分患者长期单药使用EGFR-TKI治疗并达到缓解,但几乎所有患者最终都会因继发性耐药而出现疾病进展。最常见的继发耐药机制是EGFR二次突变,耐药进展后的重复活检发现其中T790M突变约占50-65%。三代EGFR-TKIs正是一种不可逆的针对EGFR T790M及敏感突变的抑制剂,对EGFR野生型无明显作用。其中osimertinib针对EGFR-TKI治疗后耐药的T790M突变患者已表现出显著地治疗应答,mPFS达9.6个月,同时该药还因可穿透血脑屏障成为脑转移患者的治疗选择。TKI治疗进展后基因状态指导治疗的重要性以及组织标本获取的困难,也逐渐凸显了血液检测的应用价值。研究显示血浆检测EGFR T790M突变有较高的敏感度(70-77%),且血浆检测T790M阳性的患者使用osimertinib治疗与组织阳性患者的mPFS相似。其他三代EGFR-TKIs如olmutinib、ASP8273、EGF816、PF-06747775也都在进行临床试验。
对于三代EGFR-TKI,继发性耐药也已经出现。其中EGFR C797S突变是其中较常见的耐药机制之一。其他包括旁路信号通道,如MET扩增、HER2扩增或AXL活化;或表型转化,如转化为小细胞癌;或上皮细胞间质转型(EMT)等都可导致各代EGFR-TKI耐药。
KRAS突变
KRAS突变是肺癌中较常见的驱动基因变异,常见于肺腺癌、吸烟、非亚裔,但其靶向治疗的进展并不乐观。有研究显示MEK抑制剂selumetinib与紫杉醇联用可改善KRAS阳性的NSCLC。KRAS突变类型很多,不同突变类型可能激活不同的下游信号通路,一种针对KRAS G12C突变的特异性抑制剂已研发并已显示某种潜在治疗可能。此外,KRAS突变还与许多其它基因变异相关,如TP53、CDKN2A/B突变等,不同共同突变的肿瘤有不同的基因表达,可能需要不同的治疗。临床前研究显示FGFR抑制剂可能对KRAS突变的肺癌有效,尤其是间质表型。MEK与CDK4抑制剂或CHK1和MK2抑制剂的联合治疗也值得期待。
ALK融合
约3-5%的NSCLC患者存在ALK基因与其它基因融合。研究结果显示相比标准化疗方案,ALK/MET/ROS1的TKI crizotinib无论用于一线或二线的治疗,均明显延长ALK阳性肺癌患者的mPFS。但是继发耐药也不可避免地出现了,其中最主要的就是ALK的二次突变,突变类型众多,包括1151T、L1152A、C1156T、I1171T等。
为了克服这些耐药突变,新的ALK抑制剂也已出现,包括ceritinib、alectinib、brigatinib、X-396、lorlatinib。这些新TKI相较crizotinib有诸如特异性更佳(如不抑制MET和ROS1)、更敏感、可以跨越血脑屏障以及克服耐药性的不同激活范围等潜在优势。最初,这些TKI都是作为克服crizotinib耐药而被评价并表现出显著治疗应答和较好的mPFS,且对脑转移和脑膜转移患者也有治疗应答。之后在与crizotinib进行一线治疗对比的临床研究中,甚至表现出更优异的应答率和更长的PFS。目前,我们仍需要更多更完整的数据来判断这些新的ALK抑制剂是否应作为一线治疗或是crizotinib耐药进展后的二线治疗方案。

为改善无EGFR突变及ALK融合的NSCLC患者的疗效,研究者们探寻出更多新的驱动基因突变,将患者区分成不同的分子亚型并给予相应靶向治疗。
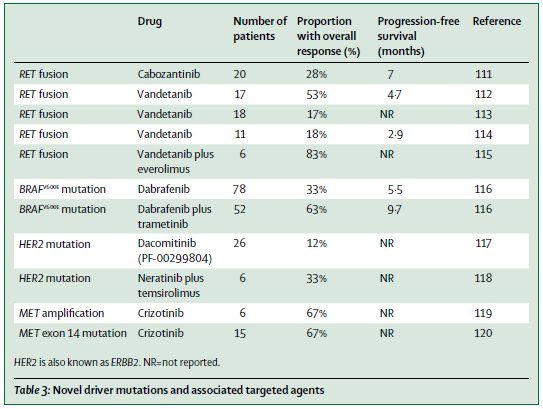 ROS1融合
ROS1融合
NSCLC患者中ROS1融合发生率约1-2%,多见于腺癌、年轻、不吸烟患者,目前已发现14种融合类型。Crizotinib已被FDA批准用于治疗ROS1阳性NSCLC患者,一项面对东亚患者的II期临床研究也表现出优异的疾病控制率(DCR)及PFS,该研究ROS1阳性患者筛选证实采用艾德生物已获CFDA批准的ROS基因融合检测试剂盒,该结果已在2016年ASCO及CSCO上公布。其他ROS1抑制剂,包括ceritinib、cabozantinib、entrectinib和lorlatinib也已在进行临床试验,并表现出对crizotinib耐药进展的ROS1融合阳性NSCLC患者的抗肿瘤活性。
RET融合
NSCLC患者中RET融合发生率约1-2%,常见于不吸烟、年轻、腺癌或腺鳞癌患者。多靶点TKI对RET激酶有效,目前已在进行I期或II期临床试验,如sunitinib、sorafenib、vandetanib、cabozantinib、alectinib、apatinib等。
BRAF突变
BRAF是KRAS下游重要的信号分子,可激活MAP信号通路。BRAF突变在肺癌的发生率约2%,主要发生在吸烟、腺癌,其中约一半为BRAF V600E突变。研究显示vemurafenib对BRAF V600E阳性的NSCLC患者有效,dabrafenib和其他BRAF抑制剂会引起RAS信号代偿性增加,因此研究者进行了BRAF抑制剂和MEK抑制剂联合治疗的疗效观察,BRAF V600E突变肺癌患者显示更高的应答率。目前尚没有非V600E的BRAF突变患者的临床治疗数据。
HER2突变
HER2突变在NSCLC中的发生率约1-2%,主要见于女性、不吸烟、腺癌,大多为20外显子的插入突变。一项回顾性分析显示HER2突变阳性NSCLC表现出很高的DCR(接受trastuzumab治疗者的DCR为93%,接受afatinib治疗者的DCR为100%);在afatinib的一项2期扩展研究中,入组的3名HER2阳性患者均对afatinib有治疗应答。因数据量较少,仍有待进一步研究。
MET扩增或突变
MET信号可通过扩增或14外显子剪切突变激活,肺癌中突变发生率约3%,扩增发生率约1-2%,通常不与其它驱动基因突变共存。初步研究显示MET抑制剂包括crizotinib和cabozantinib对携带MET突变的患者有效。MET扩增及过表达可能导致EGFR或其他TKI治疗后进展,对于联合MET抑制剂与这些TKI共同治疗也正在研究中。其他MET抑制剂如INC280、MGCD265、volitinib也正在进行临床研究。
始于IPASS研究的根据驱动基因状态选择靶向治疗的模式已成为肺癌诊疗的经典模式,随着对肺癌驱动基因不断深入的研究和探寻,越来越多的靶向药物不断涌现,令人振奋的同时也提出了挑战,如何在众多靶向药物中选择最合适的治疗方案是实现肺癌精准诊疗的基本要求。精准医学时代,基因检测已成为肺癌诊治的第一步,无论是初始治疗或是耐药决策都应检测先行。快速、全面了解患者的可靶向基因状态,才能真正让患者从靶向治疗中获益!
参考文献:
1.New and emerging targeted treatments in advanced non-small-cell lung cancer. Hirsch FR et al. Lancet. 2016 Sep 3;388(10048):1012-24. (转化医学网360zhyx.com)
第一代EGFR-TKI——Gefitinib的获批上市,为肺癌开启了分子靶向治疗的新征程。EGFR-TKI针对EGFR突变亚型患者所表现的高治疗应答率证实了靶基因变异状态对靶向药物疗效的预测作用。另一方面,研究者不断探寻更多肺癌其他驱动基因,并陆续发现了ALK融合、HER2及BRAF突变、MET跳跃突变、以及ROS1、RET等其它基因变异,相应的靶向药物也不断涌现,甚至对于EGFR突变及ALK融合型肺癌,能够克服继发耐药的二代乃至三代的TKI药物都已出现。近十年肺癌治疗已进入靶向治疗时代,并从最初的一代EGFR-TKI一枝独秀迎来如今二代、三代TKI以及越来越多其他靶基因抑制剂百花齐放!
【柳暗花明又一村:熟悉的基因,新的治疗选择】
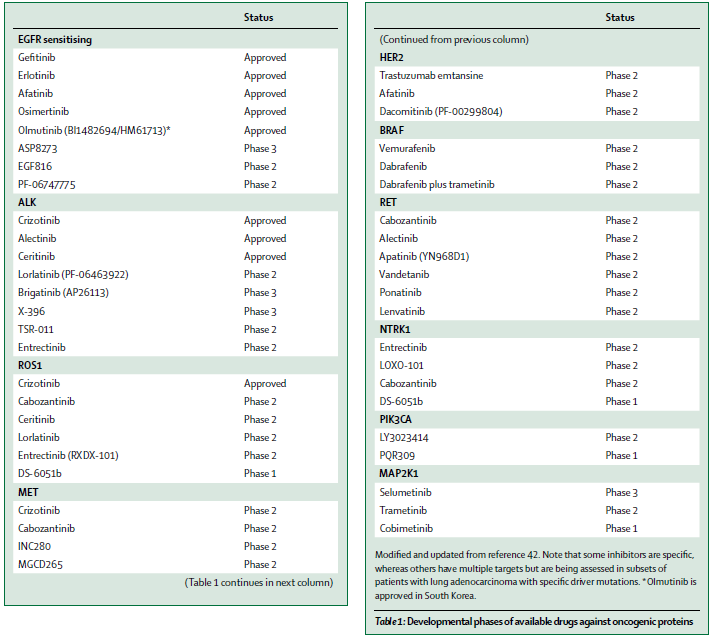
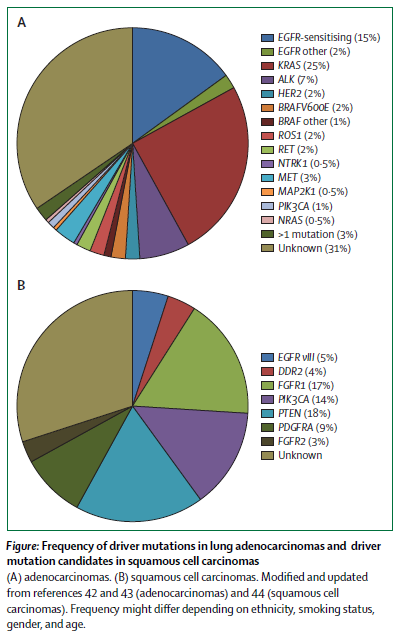
许多大型III期临床试验均已证实在EGFR突变阳性的NSCLC患者的一线治疗中,EGFR-TKI和化疗相比表现出更显著的疗效、更低的毒副作用及更优异的生存质量。因此,几乎所有的指南均推荐EGFR-TKI(如gefitinib、erlotinib或afatinib)作为EGFR突变阳性患者的一线治疗方案。
不同的EGFR-TKI针对不同的EGFR突变类型表现出不同的治疗反应差异。如相比EGFR 21外显子L858R突变,二代EGFR-TKI afatinib针对EGFR 19外显子缺失突变患者的OS延长作用更为明显。同时LUX-Lung 7结果也提示afatinib相较gefitinib可明显延长患者的PFS,但OS无显著差异。因此对靶向药物的选择应综合考虑EGFR不同位点突变类型,以及患者的体力状态、治疗便利性及不良反应等(如肝毒性更常见于gefitinib;而腹泻和皮肤毒性更常见于afatinib)。EGFR 20外显子插入突变的NSCLC患者对目前所有临床获批的EGFR-TKI均不敏感,但已经有一种新药EGF816在实验模型上表现出了治疗有效性。
尽管部分患者长期单药使用EGFR-TKI治疗并达到缓解,但几乎所有患者最终都会因继发性耐药而出现疾病进展。最常见的继发耐药机制是EGFR二次突变,耐药进展后的重复活检发现其中T790M突变约占50-65%。三代EGFR-TKIs正是一种不可逆的针对EGFR T790M及敏感突变的抑制剂,对EGFR野生型无明显作用。其中osimertinib针对EGFR-TKI治疗后耐药的T790M突变患者已表现出显著地治疗应答,mPFS达9.6个月,同时该药还因可穿透血脑屏障成为脑转移患者的治疗选择。TKI治疗进展后基因状态指导治疗的重要性以及组织标本获取的困难,也逐渐凸显了血液检测的应用价值。研究显示血浆检测EGFR T790M突变有较高的敏感度(70-77%),且血浆检测T790M阳性的患者使用osimertinib治疗与组织阳性患者的mPFS相似。其他三代EGFR-TKIs如olmutinib、ASP8273、EGF816、PF-06747775也都在进行临床试验。
对于三代EGFR-TKI,继发性耐药也已经出现。其中EGFR C797S突变是其中较常见的耐药机制之一。其他包括旁路信号通道,如MET扩增、HER2扩增或AXL活化;或表型转化,如转化为小细胞癌;或上皮细胞间质转型(EMT)等都可导致各代EGFR-TKI耐药。
KRAS突变
KRAS突变是肺癌中较常见的驱动基因变异,常见于肺腺癌、吸烟、非亚裔,但其靶向治疗的进展并不乐观。有研究显示MEK抑制剂selumetinib与紫杉醇联用可改善KRAS阳性的NSCLC。KRAS突变类型很多,不同突变类型可能激活不同的下游信号通路,一种针对KRAS G12C突变的特异性抑制剂已研发并已显示某种潜在治疗可能。此外,KRAS突变还与许多其它基因变异相关,如TP53、CDKN2A/B突变等,不同共同突变的肿瘤有不同的基因表达,可能需要不同的治疗。临床前研究显示FGFR抑制剂可能对KRAS突变的肺癌有效,尤其是间质表型。MEK与CDK4抑制剂或CHK1和MK2抑制剂的联合治疗也值得期待。
ALK融合
约3-5%的NSCLC患者存在ALK基因与其它基因融合。研究结果显示相比标准化疗方案,ALK/MET/ROS1的TKI crizotinib无论用于一线或二线的治疗,均明显延长ALK阳性肺癌患者的mPFS。但是继发耐药也不可避免地出现了,其中最主要的就是ALK的二次突变,突变类型众多,包括1151T、L1152A、C1156T、I1171T等。
为了克服这些耐药突变,新的ALK抑制剂也已出现,包括ceritinib、alectinib、brigatinib、X-396、lorlatinib。这些新TKI相较crizotinib有诸如特异性更佳(如不抑制MET和ROS1)、更敏感、可以跨越血脑屏障以及克服耐药性的不同激活范围等潜在优势。最初,这些TKI都是作为克服crizotinib耐药而被评价并表现出显著治疗应答和较好的mPFS,且对脑转移和脑膜转移患者也有治疗应答。之后在与crizotinib进行一线治疗对比的临床研究中,甚至表现出更优异的应答率和更长的PFS。目前,我们仍需要更多更完整的数据来判断这些新的ALK抑制剂是否应作为一线治疗或是crizotinib耐药进展后的二线治疗方案。

【众里寻他千百度:罕见的基因,更多的治疗选择】
为改善无EGFR突变及ALK融合的NSCLC患者的疗效,研究者们探寻出更多新的驱动基因突变,将患者区分成不同的分子亚型并给予相应靶向治疗。

NSCLC患者中ROS1融合发生率约1-2%,多见于腺癌、年轻、不吸烟患者,目前已发现14种融合类型。Crizotinib已被FDA批准用于治疗ROS1阳性NSCLC患者,一项面对东亚患者的II期临床研究也表现出优异的疾病控制率(DCR)及PFS,该研究ROS1阳性患者筛选证实采用艾德生物已获CFDA批准的ROS基因融合检测试剂盒,该结果已在2016年ASCO及CSCO上公布。其他ROS1抑制剂,包括ceritinib、cabozantinib、entrectinib和lorlatinib也已在进行临床试验,并表现出对crizotinib耐药进展的ROS1融合阳性NSCLC患者的抗肿瘤活性。
RET融合
NSCLC患者中RET融合发生率约1-2%,常见于不吸烟、年轻、腺癌或腺鳞癌患者。多靶点TKI对RET激酶有效,目前已在进行I期或II期临床试验,如sunitinib、sorafenib、vandetanib、cabozantinib、alectinib、apatinib等。
BRAF突变
BRAF是KRAS下游重要的信号分子,可激活MAP信号通路。BRAF突变在肺癌的发生率约2%,主要发生在吸烟、腺癌,其中约一半为BRAF V600E突变。研究显示vemurafenib对BRAF V600E阳性的NSCLC患者有效,dabrafenib和其他BRAF抑制剂会引起RAS信号代偿性增加,因此研究者进行了BRAF抑制剂和MEK抑制剂联合治疗的疗效观察,BRAF V600E突变肺癌患者显示更高的应答率。目前尚没有非V600E的BRAF突变患者的临床治疗数据。
HER2突变
HER2突变在NSCLC中的发生率约1-2%,主要见于女性、不吸烟、腺癌,大多为20外显子的插入突变。一项回顾性分析显示HER2突变阳性NSCLC表现出很高的DCR(接受trastuzumab治疗者的DCR为93%,接受afatinib治疗者的DCR为100%);在afatinib的一项2期扩展研究中,入组的3名HER2阳性患者均对afatinib有治疗应答。因数据量较少,仍有待进一步研究。
MET扩增或突变
MET信号可通过扩增或14外显子剪切突变激活,肺癌中突变发生率约3%,扩增发生率约1-2%,通常不与其它驱动基因突变共存。初步研究显示MET抑制剂包括crizotinib和cabozantinib对携带MET突变的患者有效。MET扩增及过表达可能导致EGFR或其他TKI治疗后进展,对于联合MET抑制剂与这些TKI共同治疗也正在研究中。其他MET抑制剂如INC280、MGCD265、volitinib也正在进行临床研究。
始于IPASS研究的根据驱动基因状态选择靶向治疗的模式已成为肺癌诊疗的经典模式,随着对肺癌驱动基因不断深入的研究和探寻,越来越多的靶向药物不断涌现,令人振奋的同时也提出了挑战,如何在众多靶向药物中选择最合适的治疗方案是实现肺癌精准诊疗的基本要求。精准医学时代,基因检测已成为肺癌诊治的第一步,无论是初始治疗或是耐药决策都应检测先行。快速、全面了解患者的可靶向基因状态,才能真正让患者从靶向治疗中获益!
参考文献:
1.New and emerging targeted treatments in advanced non-small-cell lung cancer. Hirsch FR et al. Lancet. 2016 Sep 3;388(10048):1012-24. (转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发