【亿康盘点】2017单细胞扩增测序技术的最新进展
| 导读 | 单细胞研究近年来颇受青睐,频频登上“CNS”荣誉殿堂。2017年单细胞扩增测序技术又有哪些新突破,一起来看! 精彩不容错过~~ |
细胞是构成生命体的结构和功能的基本单位,不同类型的细胞形态迥异,功能也各不相同。即使是同类细胞间看似相同,相互间也存在着广泛的细胞异质性。传统的群体细胞分析检测能更快速方便的获得大量数据并利于进行有效的统计学分析,但是随着研究的深入,这种基于群体细胞分析所获得的平均性数据,往往忽略了细胞个体间的差异,在很大程度上掩盖了不少稀有、微量样本的作用以及在生命体内广泛存在的随机行为,这些“平均”结果带来的数据缺失,甚至是与事实相反的错误结果,都是基于群体分析无法避免的结果。而针对单细胞水平的细胞异质性研究,则在很大程度上弥补了这一缺陷,也逐渐成为近年来科学家们关注的重点。下面我们来盘点一下2017单细胞扩增测序技术的最新进展。
· Science报道新型单细胞全基因组线性扩增技术有助避免遗传病——LIANTI
谢晓亮院士在4月14日的Science上发表文章报道其最新研究成果:一种新型的单细胞基因组线性扩增的方法—LIANTI(Linear Amplification with Transposon Insertion)。自2012年谢院士团队发明MALBAC®技术以来,单细胞扩增测序已被广泛应用于生殖遗传,癌症肿瘤,生命科学等研究中。新的LIANTI法基于转座子插入的线性扩增方法,跟以前的MALBAC,DOP-PCR,MDA等技术相比,在扩增基因覆盖率,保真性等所有指标上都有大幅度提高,让单细胞扩增与测序更加精准,为生命科学和转化医学的研究提供了更有力的保障。
LIANTI法通过转座子插入进行线性放大。基因组被含有T7启动子的Tn5转座子随机片段化(400bp左右),T7启动子允许线性扩增。LIANTI法优于现有的方法,测量拷贝数的空间分辨率提高了3个数量级(能在千碱基分辨率进行微CNV检测,基因组覆盖率可达到97%),由此能查出基因组上以前查不出来的一些小段碱基微缺失,直接观察从细胞到细胞不同的,随机发生的DNA复制起始。这意味着LIANTI法能更有效、更精准地检测出更多遗传疾病。

Single-cell whole-genome analyses by Linear Amplification via Transposon Insertion.Science, 2017
· 高通量单细胞组合标记测序技术力助癌症异质性研究——SCI-seq
美国俄勒冈健康与科学大学的研究人员研发出了一种称为SCI-seq(单细胞组合标记测序技术),多次对细胞进行条形码编码标记后对它们进行测序的方法。这种方法极大地扩大了能够绘制基因组图谱的单细胞数量。可以同时构建上千个单细胞文库,检测体细胞拷贝数的变异。这项技术极大的缩减了文库构建的成本,增加了检测细胞的数量,这对于体细胞变异的检测,尤其是在肿瘤进化过程中对细胞亚克隆变异研究具有重要价值。研究人员在灵长类额叶皮层组织和两个人类胰腺癌中构建了16,698个单细胞基因组文库,这大约比利用常规方法能够构建出的基因组文库大小高出两个数量级。如果我们能了解肿瘤不同细胞组分的详细情况,就能够更加精准地靶向这种癌症”。
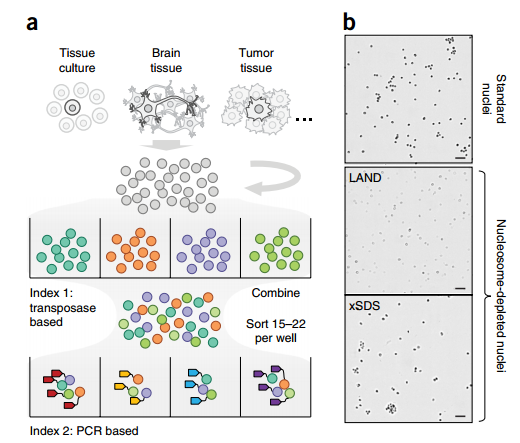
Sequencing thousands of single-cell genomes with combinatorial indexing.Nature Methods,2017
· 单细胞空间转录组测序新技术——Geo-seq
中科院生物化学与细胞生物学研究所细胞生物学国家重点实验室的景乃禾团队通过整合与优化单细胞测序和激光显微切割技术建立了一种可以获得具有空间位置信息的少量细胞转录组图谱的技术方法:Geo-seq,这种方法不仅能解析少量细胞转录组信息,而且还能保留细胞原有位置信息,从而获得单细胞空间转录组特征、转录因子和信号通路调控网络。这是一种高效、高分辨率的空间转录组分析方案。
应用:
• 可用于转录图谱的三维重建;
• 用于研究具有特殊结构的少量组织或细胞的转录组信息;
• 可以将外源的多能干细胞或者胚胎组织细胞“投递”到体内胚胎的特定位,从而将未知来源的干细胞定位于体内胚胎的相应部位。
• 已成功应用于小鼠大脑发育、肝脏肿瘤学以及人的精子发育等研究中。
Spatial transcriptomic analysis of cryosectioned tissue samples with Geo-seq.Nature Protocols, 2017
· 10X Genomics助力数字化单细胞转录组测序分析技术
10X Genomics和Fred Hutch的团队利用基于液滴的方法,让单细胞转录组学得以加速。他们使用了一种微流体平台,基于GemCode技术,将带有条形码、索引分子、引物及其他的凝胶珠与单细胞混合。每个液滴内开展逆转录反应,以产生测序所用的带有条形码的cDNA。这种细胞封装大约有50%的捕获效率,可在6分钟内发生。它能够分析来自29个不同样品的250,000个单细胞,并根据SNV来区分单个细胞。这项新的单细胞RNA测序方法,可实现数千个免疫细胞的分析。
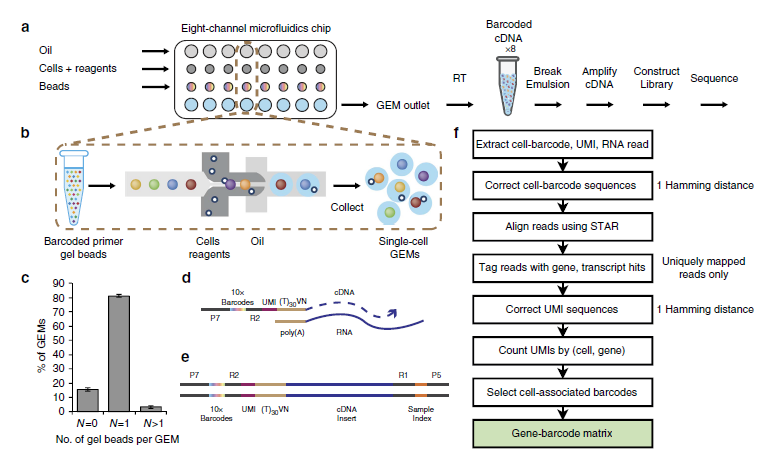
Massively parallel digital transcriptional profiling of single cells.Nature Communications,2017
· CRISPR液滴法单细胞RNA测序技术——CROP-seq
奥地利科学院CeMM分子医学研究中心的Christoph Bock及其团队通过创造性地将两种极有前景的基因组学领域结合在一起,发明了这种被称作CROP-seq的单细胞测序方法(CRISPR droplet sequencing,CRISPR液滴测序),能够在利用其它方法很难实现的规模和细节上高通量地分析基因调控,有效的弥补了传统单细胞测序由于细胞筛选导致的不足。
Bock团队首先结合了CRISPR集中筛选和按序筛选的优势,将CRISPR基因组编辑与单细胞RNA测序整合在一起,可实现同时研究上千个细胞的基因调控影响。随后Paul Datlinger构建出一种病毒载体,能够让CRISPR gRNA在单细胞测序实验中可视化观察,再结合最新的用于单细胞RNA测序的液滴方法足以高通量地分析单个细胞中上千种基因组编辑事件的影响。
这种方法能够产生首批人类基因组上2.3万个基因中每个基因的调节影响的综合图谱。属于CROP-seq的所有数据、操作流程、试剂和软件将会免费地分享给大众,从而能够让其他的科学家们在他们的研究中使用和推广这种方法。
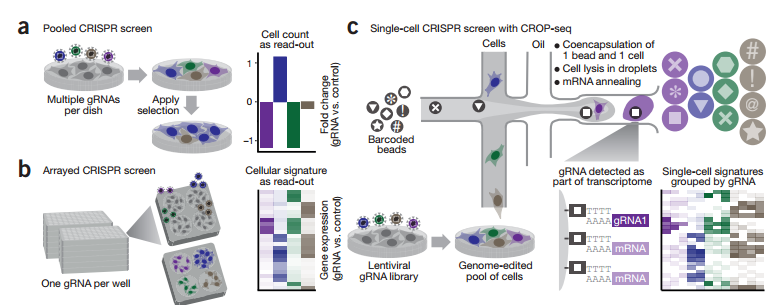
Pooled CRISPR screening with single-cell transcriptome readout.Nature Method, 2017
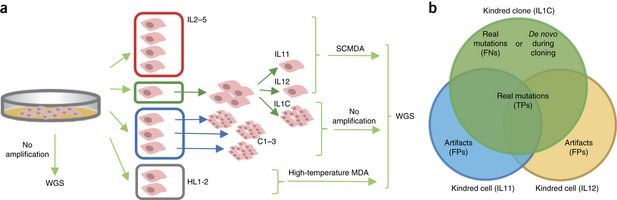
· 单细胞基因组突变检测技术——SCMDA
爱因斯坦医学院的Jan Vijg博士宣布开发并验证了一种能够准确鉴定单细胞基因组基因突变(单核苷酸变异分析)的新方法:单细胞多重置换扩增(SCMDA)和单细胞变异“访客”技术——可以修复基因扩增过程中发生的核苷酸序列错误的技术。通过比较发现这种方法比目前市场上用于基因组分析的技术效果更好。
“能够鉴定人体单细胞基因突变很重要,因为这可以在癌症早期告诉我们患癌的风险。”Vijg博士说,史上首次,我们的基因组分析方法允许我们精确的评估她们患乳腺癌的风险。我们能够对几个单细胞进行测序,以检测这些细胞中有多少基因突变,以及这些基因突变是否远高于不患癌症的病人的细胞中的基因突变。”除了可以评估人体患癌风险,这种可以鉴定单细胞基因突变的新方法还可以帮助揭示基因突变在人体衰老中的作用。
· 单细胞多组学平行测序
理解一个器官的发育和功能需要对组成该器官的所有细胞类型的特性有一个清晰的认识。传统发现和分离细胞亚群的方法是基于几个已知的标记基因表达出来的信使RNA或蛋白质实现的。但是对于一些罕见的细胞类型来说,鉴定出它们特定的标记基因目前仍存在很大挑战。而发现一些罕见的细胞类型,如干细胞,短暂存在的前体细胞,癌症干细胞或循环肿瘤细胞,对于深入理解正常和疾病状态下的组织生物学具有非常重要的意义。这项研究通过开发一种算法分析转录组测序结果,能够在复杂的单细胞群体中发现一些罕见的细胞类型及其特定标记基因,对于了解正常的和疾病状态下的组织生物学具有重要意义。

Single-Cell Multiomics: Multiple Measurements from Single Cells.Trends in Genetics,2017
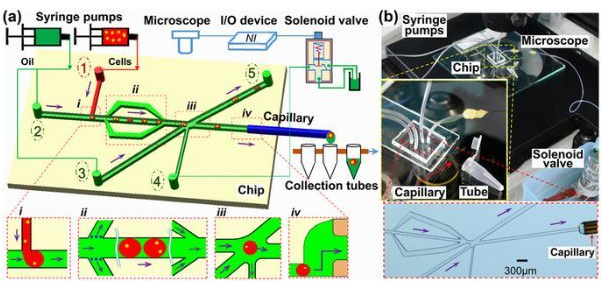
· One-Cell-One-Tube的单细胞分离测序技术——FOCOT
中国科学院青岛生物能源与过程研究所单细胞研究中心研究员马波带领的微流控系统团队通过设计简易高效的单细胞分选与测序对接装置,发明了每个试管有且只有一个细胞(One-Cell-One-Tube)的FOCOT技术,有望服务于"现场"、"实时"乃至"便携式"的单细胞分选与测序。该方法能够精确、高速、低成本地分离、获取与分装单个微生物细胞,从而与单细胞测序直接对接。该方法具体为:首先,通过微流控技术,将细胞分散包裹在数十微米直径的油包水微液滴中;然后,基于液滴显微光学成像识别技术,分选出单细胞包裹液滴;最后,将单细胞包裹液滴顺序分布于一系列试管中,从而快速实现单个细胞的分离,以及每个试管有且只有一个细胞,以实现与单细胞全基因组扩增与测序的直接对接。
还想了解最新的单细胞研究方法和应用吗?敬请期待~
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录

还没有人评论,赶快抢个沙发