NSCLC诊疗临床启示录
| 导读 | 近十年,基于EGFR基因检测指导下的表皮生长因子受体酪氨酸激酶抑制剂的临床应用,推动晚期非小细胞肺癌(NSCLC)个体化诊疗的发展。与此同时,随着NSCLC驱动基因的深入研究和相关靶向药物的陆续上市,越来越多EGFR以外的驱动基因进入人们的视野,其靶向药物已经从一代的明星药物克唑替尼发展到了目前即将上市的二代、三代色瑞替尼、劳拉替尼等。NSCLC的诊疗进入了“精准医学”新时期,而对于EGFR、ALK、ROS1等与靶向治疗相关的驱动基因的检测也已成为新时期下NSCLC诊疗的新常态。
在这种新常态下,基于基因检测的临床研究为我国NSCLC诊疗提供了循证医学的证据,而基于临床循证医学证据的各类临床指南共识,则进一步推动NSCLC诊疗的规范化进程。 |
近十年,基于EGFR基因检测指导下的表皮生长因子受体酪氨酸激酶抑制剂(吉非替尼、厄洛替尼、埃克替尼)的临床应用,推动晚期非小细胞肺癌(NSCLC)个体化诊疗的发展。与此同时,随着NSCLC驱动基因的深入研究和相关靶向药物的陆续上市,越来越多EGFR以外的驱动基因进入人们的视野,如ALK、ROS1,其靶向药物已经从一代的明星药物克唑替尼发展到了目前即将上市的二代、三代色瑞替尼、劳拉替尼等。NSCLC的诊疗进入了“精准医学”新时期,而对于EGFR、ALK、ROS1等与靶向治疗相关的驱动基因的检测也已成为新时期下NSCLC诊疗的新常态。
在这种新常态下,基于基因检测的临床研究为我国NSCLC诊疗提供了循证医学的证据,而基于临床循证医学证据的各类临床指南共识,则进一步推动NSCLC诊疗的规范化进程。
一、中国NSCLC诊疗临床研究启示
Epidermal growth factor receptor gene mutation status in pure squamous-cell lung cancer in Chinese patients1
中国患者单纯肺鳞癌中EGFR基因突变情况
本研究共入组185例来自上海胸科医院的肺腺鳞癌患者。经H&E染色读片及IHC评估筛选单纯性肺鳞癌163例,采用ADx-ARMS®检测EGFR突变率17.2%(28/163),更多见于女性(28.6%,P=0.022)、不吸烟(26.2%,P=0.049)患者,年龄及分化程度与突变率无明显相关。研究证实单纯肺鳞癌中存在EGFR突变,肯定了所有肺鳞癌患者进行EGFR突变检测的重要性。
EGFR mutation status and its impact on survival of Chinese non-small cell lung cancer patients with brain metastases2
EGFR基因突变状态及对中国NSCLC脑转移患者的生存影响
脑转移是NSCLC的死因之一,NSCLC原发灶EGFR基因突变状态与EGFR-TKIs相关,因此明确脑转移灶中EGFR基因突变状态至关重要。本研究回顾性评估2007-2012年来自中国南部8个中心的NSCLC患者,共入组136例脑转移患者,其中15例有原发灶及转移灶配对标本。采用ADx-ARMS®检测脑转移灶中EGFR突变率52.9%(72/136),常见于女性及不吸烟患者。原发灶与转移灶突变一致率为93.3%(14/15),阳性预测值100%,阴性预测值87.5%。EGFR基因野生型及突变型脑转移手术治疗的mPFS分别为12个月和10个月(P=0.594),mOS分别为24.5个月和15个月(P=0.248)。研究结论:NSCLC原发灶与配对脑转移灶的EGFR突变高度一致,原发灶可作为替代样本预测脑转移灶中EGFR基因的突变状态,反之亦然。
EGFR Mutations in Surgically Resected Fresh Specimens from 697 Consecutive Chinese Patients with Non-Small Cell Lung Cancer and Their Relationships with Clinical Features3
697例中国NSCLC患者手术切除新鲜组织的EGFR基因突变状态及临床特征相关性
本研究入组2012年1月至2013年8月来自唐都医院胸外科的697名手术切除的NSCLC患者,包括312名胸腔镜手术患者及385名开胸手术患者。采用ADx-ARMS®检测EGFR基因突变状态,其中TKIs敏感突变235例(33.7%),包括41例鳞癌(14.5%)、155例腺癌(52.9%)、86例腺鳞癌(39.5%)、1例大细胞癌(9.1%)、2例肉瘤样癌(11.1%)及2例黏液表皮样癌(28.6%)。TKIs敏感突变更常见于女性(P<0.001)、不吸烟(P=0.047)及腺癌(P<0.001)。19缺失突变率为43.4%、L858R为48.1%、L861Q为1.7%、G719X为6.8%。在3例鳞癌及3例腺癌中检出EGFR T790M突变,在2例腺癌中检出20外显子插入突变。研究者认为,EGFR基因突变检测应作为中国NSCLC患者术后的常规检测。
Epidermal growth factor receptor (EGFR) mutations in non-small cell lung cancer (NSCLC) of Yunnan in southwestern China4
中国云南地区NSCLC EGFR基因突变状况
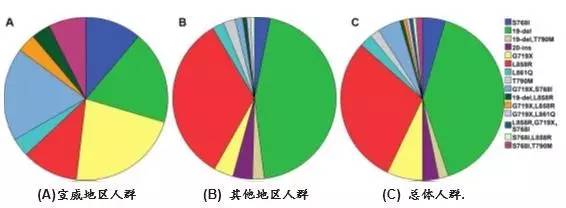
本研究入组2015年8月至2016年7月间来自昆明医科大学附属医院的447例病理确诊为NSCLC的患者,检测标本包括175例组织标本、256例血浆标本及16例细胞学标本。采用ADx-ARMS®进行检测。EGFR基因总体突变率为34.9%(其中组织42.3%、血浆29.7%、细胞学37.5%)。女性(P<0.0001)、不吸烟(p=0.001)、腺癌(P<0.0001)、组织标本(P=0.026)的突变率较高。最常见的突变类型是19外显子缺失(40%)和L858R(30%)。值得注意的是,相比其它地区,来自宣威地区的患者EGFR基因突变类型分布比较特别,G719X突变和G719X/S768I双突变较多,19外显子缺失和L858R突变比较少。总体上看,云南省的EGFR基因突变率及分布与其他亚洲人群基本一致,但是宣威地区较其他人群显示出明显不同的突变分布。研究结果还表明,对于组织样本不足以进行分子检测的患者使用ctDNA用于EGFR基因突变检测是可行的。
Intratumoral Heterogeneity of ALK-Rearranged and ALK EGFR Co-altered Lung Adenocarcinoma5
ALK重排和ALK/EGFR联合突变肺腺癌的肿瘤异质性
本研究采用了ARMS和RT-PCR方法检测EGFR突变和ALK融合,筛选出所有ALK阳性和EGFR突变阳性患者,再结合显微切割技术分析腺癌亚型区域、不同亚克隆等的分子特征。

该研究第一次在大样本人群(629例)中发现在ALK阳性,EGFR突变阳性,及ALK/ EGFR双突变肺腺癌瘤内分子表型的异质性与组织学异质性共存。尤其在ALK/EGFR双突变阳性患者中,ALK融合与EGFR突变可存在于同一细胞内,也可分别单独存在于不同细胞,提示肿瘤群体可能起源于不同亚克隆,并在肿瘤发生发展过程中不断演变,从而导致同一肿瘤内不同部位驱动基因表型的不同。研究表明ALK通路在肺腺癌包括ALK/EGFR双突变腺癌中的关键驱动作用,为ALK/EGFR双突变患者的靶向联合治疗提供了证据。同时也是ALK阳性患者NSCLC患者ALK抑制剂治疗过程中耐药机制研究的重大突破,对于TKI耐药后的治疗策略具有重大指导意义。
Malignant pleural effusion cell blocks are substitutes for tissue in EML4-ALK rearrangement detection in patients with advanced non-small-cell lung cancer6
恶性胸腔积液细胞可替代组织检测晚期非小细胞肺癌患者EML4-ALK融合
本研究回顾性分析了109例NSCLC患者,探讨利用恶性胸腔积液(MPE)分析EML4-ALK状态的可行性,并评估以MPE诊断的EML4-ALK分子状态的预后价值。样本经过RT-PCR和其他多种方法确认,结果显示:共检出5例ALK阳性,同时有组织和MPE样本配对的共21例,符合率100% (21/21)。 相比于组织,敏感度和特异性分别为100% (2/2) 和100% (19/19),表明NSCLC患者EML4-ALK分子状态MPE检测可作为组织检测的一个补充方案。并且这些ALK融合的患者对比EGFR突变和EGFR/ALK双阴性患者化疗效果上PFS表现出一定的延长(9.27 vs 6.53个月和4.67个月,P = 0.122),提示MPE诊断EML4-ALK可能还具备治疗的预测价值。
Clinical outcomes of advanced non-small-cell lung cancer patients with EGFR mutation, ALK rearrangement and EGFR/ALK co-alterations7
EGFR突变、ALK重排及EGFR/ALK联合突变非小细胞肺癌患者的临床结果
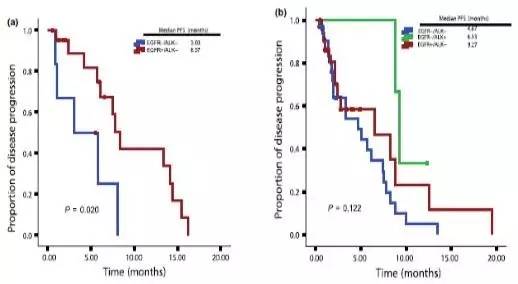
本研究招募了118位使用TKI治疗的晚期NSCLC患者,检测EGFR突变与ALK重排,探讨罕见的EGFR/ALK双突变患者相关的临床特征。该研究发现10例中有9例EGFR/ALK双突变患者一线使用TKI有很好的反应率(双突变患者ORR达80%,EGFR突变患者ORR为65.5%,中位PFS则为11.2 vs 13.2);克唑替尼治疗EGFR/ALK合并突变患者的ORR为40% (2/5),而ALK重排患者的ORR为 73.9% (17/23),PFS为1.9 vs 6.9月。另外EGFR突变、ALK重排、EGFR/ALK双突变患者的OS 分别为21.3、23.7和18.5个月(P= 0.06),在ALK重排、EGFR/ALK双突变患者的OS之间有明显统计学差异 (P=0.03)。 研究提示:在EGFR/ALK双突变患者中,一线使用EGFR-TKI治疗可能是合理的方案,且无论是否序贯使用克唑替尼治疗都应明确ALK重排状态及ALK和EGFR的磷酸化水平,药物使用前的检测非常重要。
Efficacy of crizotinib and pemetrexed-based chemotherapy in Chinese NSCLC patients with ROS1 rearrangement8
中国ROS1重排NSCLC患者使用培美曲塞为基础的化疗与克唑替尼的疗效
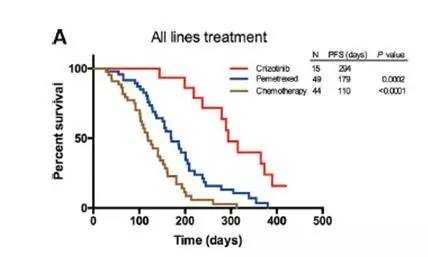
本研究旨在探讨中国人群中ROS1重排的NSCLC患者使用培美曲塞为基础的化疗与克唑替尼疗效。入组2309例NSCLC患者,使用RT-PCR法检测ROS1重排状态,发现51(2.2%)例ROS1重排。对于ROS1融合阳性患者,与各治疗组相比,crizotinib治疗组有更高的总体反应率(ORR,80%),疾病控制率(DCR,90%)和更长的无进展生存期(PFS,294天),培美曲塞组(ORR,40.8%;DCR,71.4%;PFS,179天),非培美曲塞组(ORR,25%;DCR,47.7%;PFS,110天)。
二、新常态下的NSCLC诊疗规范
EGFR、ALK、ROS1等驱动基因突变的检测在NSCLC的治疗、预后、疗效预测等方面的价值已获得临床验证,成为广泛共识并写入各大临床指南和专家共识之中。以美国NCCN肺癌临床实践指南为例,对NSCLC的分子分型检测已由单独的EGFR检测演化至EGFR、ALK、ROS1三基因检测,可见对这三个基因的状态的检测已成为NSCLC诊疗的新常态。
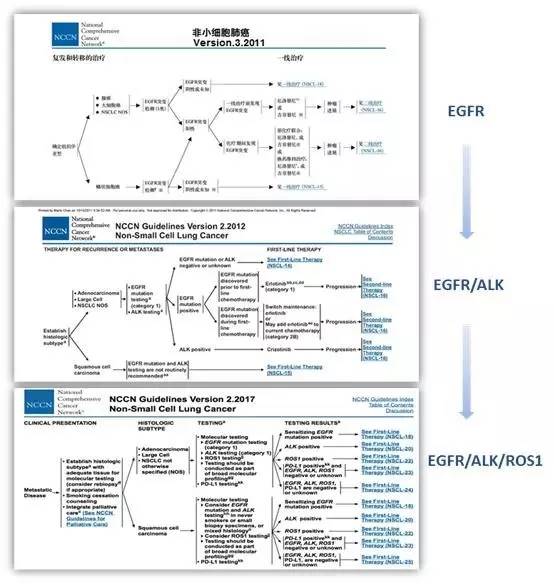
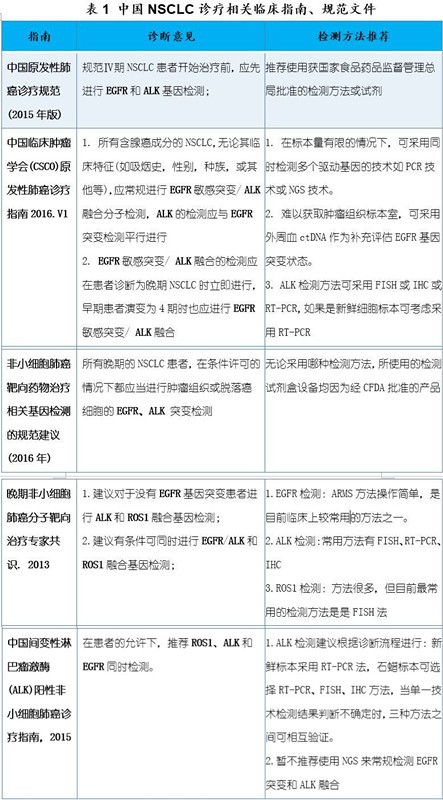
我国NSCLC诊疗指南也经历了相似的演进历程,目前,我国医学权威指南均已明确推荐肺癌患者在接受靶向治疗前进行EGFR/ALK同步检测。特别的,对于有条件的患者,建议同时对三个基因EGFR/ALK/ROS1进行同步检测(表1)。此外,在方法学上,也对各基因的检测提供了相关建议,为我国NSCLC规范化诊疗奠定了基础。
三、NSCLC诊疗新常态下的高效检测
通过上述分析可见,对EGFR、ALK和ROS1这三个基因的状态进行检测已成为NSCLC诊疗的新常态。但是具体方法的选择上如何能高效地对有限的临床样品进行分析呢?所谓“高效”是指能够在尽可能少利用样品的基础上快速地实现三个基因的检测,且结果判断相对容易。因此,基于操作简便、检测准确稳定、判读容易且临床普及的平台(如PCR平台)进行多重基因联合检测无疑是一种高效的检测方法。
在NSCLC用药检测上,目前CFDA批准的肺癌临床用药检验产品已涵盖了EGFR、ALK、ROS1这三个重要靶点。同时在产品形式上也越来越丰富,除了单基因检测产品外,已有基于荧光定量PCR平台开发的EGFR/ALK/ROS1三基因联合检测产品获批上市,这无疑将成为EGFR、ALK和ROS1这三个基因高效检测的利器,不仅可以节约样本,减少取样伤害,还能缩短检测时间,让肺癌患者获得最大的临床受益。
随着肺癌新靶点的发现和新靶向药物的研发,多基因联合检测将成为制定肺癌精准医疗决策的重要手段,目前,我国已有EGFR/ALK/ROS1三基因的联合检测产品上市,相信通过技术创新,未来,将会有检测更多靶点的高效检测产品上市,实现NSCLC诊疗新常态下的高效检测,协助临床快速制定最优治疗方案,造福广大肿瘤患者。
参考文献:
1. Zhang Q, et al. BMC Cancer. 2015 Mar 1;15:88.
2. Luo D, et al. Tumour Biol. 2014 Mar;35(3):2437-44.
3. Li X, et al. Int J Mol Sci. 2013 Dec 17;14(12):24549-59.
4. Zhou Y, et al. Oncotarget. 2017 Jan 17;8(9):15023-33.
5. Caicun Zhou,et al. J Clin Oncol. 2015 Nov 10;33(32):3701-9.
6. Wang J, et al. Cytopathology. 2016 Dec;27(6):433-443.
7. Wu YL, et al. Oncotarget. 2016 Oct 4;7(40):65185-65195.
8. Zhou CC, et al. Oncotarget. 2016 Nov 15;7(46):75145-75154.
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发