循环肿瘤细胞检测对头颈部肿瘤诊疗的临床意义
| 导读 | 头颈部肿瘤包括颈部肿瘤、耳鼻喉科肿瘤以及口腔颌面部肿瘤三大部分,据世界卫生组织(WHO)评估近年我国头颈部肿瘤的年发病率为每10万人中15.22人次(15.22/10万),占全身恶性肿瘤的4.45%。其病因尚未明确,疑与遗传因素相关,且长期接触有害物质亦为诱发因素之一。头颈部肿瘤目前以手术治疗辅以放疗化疗为主,早期无明显临床症状,芝加哥大学医学院的报道显示即使行手术或局部放化疗,其远端转移转移率仍高达4- 23%,且往往提示着不良的预后【1,2】。由于临床确诊的头颈部肿瘤主要为进展期,从而失去了最佳治疗的时机,而头颈部肿瘤的临床常见致残、致死的主要原因为肿瘤的复发和转移。外周血循环肿瘤细胞(circulating tumor cells ,CTCs)被认为与恶性肿瘤的复发、转移密切相关,因其对肿瘤的早期诊断、临床分期、复发转移和耐药监测、预后判断、开发新的治疗靶点具有重要价值。美晶医疗与临床合作代表就目前CTCs检测技术在肿瘤辅助诊疗和预后的意义进行归纳总结,以期为今后肿瘤的复发转移和耐药监测、预后判断,治疗策略的及时调整,开发新的治疗靶点提供新的思路和重要依据。 |
作者:乐飚1,宋毅1,邬振华2,郝敬铎3,沈挺1,张晓晶1
1:宁波美晶医疗技术有限公司
2:宁波市李惠利东部医院
3:宁波第七医院胃肠外科
头颈部肿瘤包括颈部肿瘤、耳鼻喉科肿瘤以及口腔颌面部肿瘤三大部分。比较常见的是甲状腺肿瘤,喉癌、副鼻窦癌及各种口腔癌(如舌癌、牙龈癌、颊癌等:见图1)。因此,头颈部肿瘤的原发部位与病理类型居全身肿瘤之首。同时,头颈部重要器官比较集中,解剖关系复杂,治疗方法各异。据WHO评估,我国近年头颈部肿瘤的年发病率为每10万人中15.22人次(15.22/10万),占全身恶性肿瘤的4.45%。按部位(图2所示),头颈肿瘤的发病依次为喉(32.1%)、甲状腺(19.6%)、口腔(16.1%)、鼻咽(14.9%)、鼻腔副鼻窦(6.6%)、大涎腺(4.2%)、口腔(3.3%)、眼(1.52%)、下咽(1.5%)。在性别上,除甲状腺肿瘤女性(14.2%)明显多于男性(5.40%)外,其余以男性居多。其病因尚未查清,有人认为与遗传因素有关;长期接触有害的化学气体及吸烟,亦为诱发因素之一。
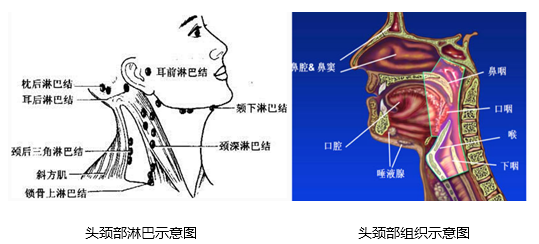
图1:头颈部淋巴结与组织示意图(源自中国医学科学院肿瘤医院头颈部肿瘤放射治疗图谱)
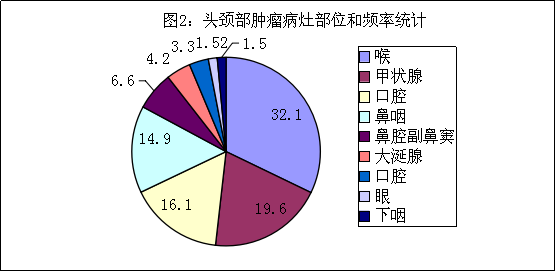
图2:头颈部肿瘤病灶部位和频率统计
循环肿瘤细胞(circulating tumor cells,CTCs)是指从原发性实体瘤或转移灶释放,突破血管从而进入外周循环血的肿瘤细胞。由于CTCs的稀有性,抗原异质性而难以富集/捕获,研究者早期主要致力于CTCs的富集与捕获。目前CTCs已成为多种类型癌症,如乳腺癌,肺癌,前列腺癌和结肠直肠癌对于良、恶性肿瘤的鉴别有一定的提示价值。美晶医疗与宁波市第二医院放化疗科,李惠利东部医院及宁波七院胃肠外科的临床合作中对不能手术或不愿手术的局部进展期胃癌患者进行同步放化疗,并观察疗效和不良反应,取得了较好的效果,发现CTCs在胃癌的预后评估及个体化治疗,疗效监控等方面具有重要的临床意义。但CTC在头颈部肿瘤中的研究相对较少。本文主要从CTCs的特性、检测手段及其在头颈部肿瘤中的应用进行概述。
1.循环肿瘤细胞的特性与检测手段
自1869年Ashworth首次报道外周血循环肿瘤细胞(circulating tumor cell ,CTCs)的发现以来,关于CTCs的出现是”肿瘤转移扩散“还是仅为原发病灶脱离的”单纯肿瘤细胞“的问题已经讨论了近半个世纪之久。在过去的10数年,伴随着分子病理学,免疫细胞组化等高敏技术的诞生,又重新燃起了CTCs临床意义的研究热潮。1996年Abati【3】等提出尽管外周血中仅有非常少的一部分CTC能存活下来并形成转移灶,但是CTC的存在就可能为转移额发生提供了基础,且近年的许多研究证实CTC的出现与患者的预后呈正向相关,美国德州大学MD Adeson病院的Christfani等数个研究团队证明,乳腺癌,结直肠癌患者CTC辅助临床诊断可以作为一个独立的预后指标。
肿瘤细胞从原发灶生长至发生转移与其他恶性肿瘤往往经历原发灶的原位生长(原位癌)、突破基底膜成为浸润癌、肿瘤细胞突破血管内皮细胞从而进入血液循环、随血液在全身播散的肿瘤细胞滞留于远处器官的毛细血管、在转移灶的定植和生长等恶性行为。在这一过程中,CTCs被认为与恶性肿瘤的复发、转移密切相关,因其对肿瘤的早期诊断、临床分期、复发转移和耐药监测、预后判断、开发新的治疗靶点具有重要价值。2012年德国海德堡大学普外科脏器与移植专业的Steiner团队在Langenbecks Arch Surg上发表的研究指出【4】,每克原发肿瘤灶或转移灶每天约有106个CTC脱落进入外周血循环,而90%的CTC因为人体的免疫调节系统和自身凋亡而失去活力,且CTC在外周血细胞中阳性率较低,与正常血细胞的比值约千万分之一到亿分之一之间。
目前CTCs检测技术主要分为物理学模式(如以细胞大小差异和过滤为基础的方法等),正向/负向筛选模式或借助微流控芯片(CTC-Chip)。作为中国自主研发的自动化循环肿瘤细胞检测系统,美晶医疗CellRichTM循环肿瘤细胞检测系统采用免疫纳米磁颗粒并结合先进的微流体芯片设计专利技术对微量细胞进行捕获和分析,是一种先进的循环肿瘤细胞检测与分析平台。该平台具备正负向细胞筛选模式:在正向筛选模式中,通过将循环肿瘤细胞上的特异抗原与纳米磁颗粒上的特异性抗体相结合,借助微流控专利技术使得含有肿瘤细胞的生物样本通过梯度磁场,从而将循环肿瘤细胞从血液或其他背景液中筛选出来。在负向筛选模式中,通过对生物体液样本进行红细胞裂解处理,配合使用与白细胞、红细胞或血小板等特异性结合的免疫微珠等技术手段将循环肿瘤细胞之外的细胞进行去除,从而消除背景干扰对循环肿瘤细胞进行检测的技术手段。而此检测技术开发完成后,将与现有循环肿瘤细胞检测系统形成良好的互补和完善。更多细节详见美晶医疗转化医学网4月刊的基于微芯片的自动化循环肿瘤细胞检测系统¾CellRichTM新型液体活检平台。其临床检测模式以iFISH(原位荧光杂交),免疫荧光及PCR法应用较多,常见的有细胞角蛋白CK19;CK20;癌胚抗原(CEA);Suivivin;Stanniocaclcin2;MicroRNA-21;各类人类染色体组(如CEP7,CEP8)等。目前,其在临床应用中最大的限制就是,缺乏特别明确的特异性标志物,以上问题导致当前CTC的研究停滞在原始阶段,对CTC的单细胞特性、分子标记物的种类及性质的理解均不充分,距离临床肿瘤病症诊疗的转化应用仍然有距离。
2.循环肿瘤细胞在头颈部肿瘤中的应用
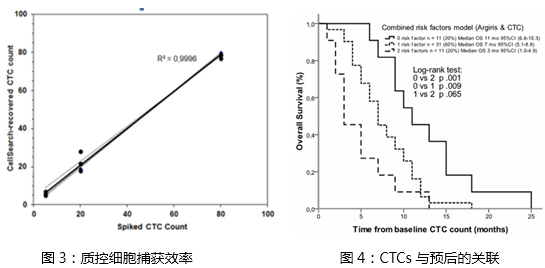
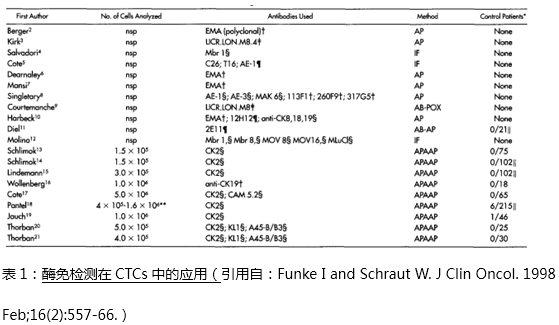
头颈部肿瘤与其它肿瘤(如乳腺癌,前列腺癌或结直肠癌)相比,过去一直认为其预后主要取决于局部复发和区域性的淋巴转移,其远处转移的发生率仅在1%左右,因此关于CTC的临床研究相对较少。然而伴随着ICC(免疫荧光检测),iFISH, PCR等高敏感,高特异性检测技术的发现与应用,又重新激起了对CTC临床意义的研究兴趣。近年许多研究证明CTC的出现不仅与患者的预后相关,还与肿瘤的组织学分级,肿瘤大小和淋巴结转移情况包括有无远处转移相关联。Wollenbergtm,Funke,Pajonk【6】等团队发表的多篇回顾性文献对于头颈部肿瘤远处转移的共识是:1)20世纪90年代,Berget等采用传统的酶免检测(例如碱性磷酸酶(AP);C26或EMA单抗的免疫荧光检测(IF);生物素-链酶亲和素架桥的辣根过氧化物酶(AB-PCX)模式;生物素-链酶亲和素架桥的碱性磷酸酶(AB-AP)模式等)几乎很难检测到目标的CTCs(表1:酶免检测在CTCs中的应用(引用自:Funke I and Schraut W. J Clin Oncol. 1998 Feb;16(2):557-66.);2)伴随着分子病理学,免疫细胞组化等高敏技术的诞生,外周血模拟试验中质控细胞的捕获率已可达到95%及以上(图3:质控细胞捕获效率);3)头颈部肿瘤是一种全身性疾病,患者的远处转移往往发生在肿瘤分级的中后期,而且预示着不良的预后。因此认为远处转移的早期诊断对头颈部肿瘤的预后至关重要,且远处转利的高发生率与更短的生存期(OS)明显相关(图4:CTCs与预后的关联:引用自:PLoS One. 2014 Aug 8)
近期宁波第七人民医院副院长兼外三科主任郝敬铎医师近日在宁波市惠民计划的赞助下,运用美晶医疗的CellRichTM新型液体活检平台对转移性肿瘤(入组数十例结直肠癌,前列腺癌,乳腺癌及头颈部肿瘤)患者实施CTCs检测时发现,在早期肿瘤患者中,利用影像学还未发现病灶时已经可以在外周血中检测到CTCs。研究表明,在疾病的早期,外周血循环肿瘤细胞对于良、恶性肿瘤的鉴别有一定的提示价值,也有助于转移风险的预测和判断;在疾病进展和治疗过程中,外周血循环肿瘤细胞能为动态检测病情、耐药性等临床诊疗的关键因素提供重要信息,有助于医师开展个性化的肿瘤治疗。
3.循环肿瘤细胞在头颈部鳞状细胞癌中的应用
头颈部鳞状细胞癌(head and neck squamous cell carcinoma: SCCHN)是头颈部最常见的恶性肿瘤,约占头颈恶性肿瘤的90%,占全身恶性肿瘤的10%。WHO统计,全球每年新增病例约65万例,治疗方式从单一手术转变为手术,放化疗,分子靶向治疗等多学科联合模式,任然有50-60%的患者出现原位复发,区域淋巴结转移,约有20%的患者发现远处转移,其5年生存率在50%左右,且近几十年来没有显著提高。因此CTCs做为可评估HNSCC的早期检测及预后的检测指标,而备受关注【7,8】。
2010年美国俄亥俄州国立儿童医院头颈部肿瘤外科Jatana团队【9】对48例HNSCC术后患者的血液样本进行CTCs计数分析,随访19个月后发现没有检测出CTCs的患者无病生存率明显高于检测出CTCs的患者,两组之间差异有统计学意义(P=0.01)。CTCs与患者年龄、性别、肿瘤位置(口腔、口咽、喉咽、喉)、肿瘤分期、是否加辅助治疗均无相关性,认为CTCs可以做为HNSCC预后不良的独立危险因素。
其后意大利巴伦西亚大学肿瘤医学科的Grisanti研究组在2014年发现,当CTCs数量》2个时,HNSCC患者的预后比CTCs数量为0-1个的患者更差,患者的疾病无进展生存率与总生存率也更差。经过治疗后8%的CTCs阳性患者得到了控制(见图5:化疗前后CTCs数量变化与预后关联)。该实验结果刊登在2014年注明期刊Pos One【10】。
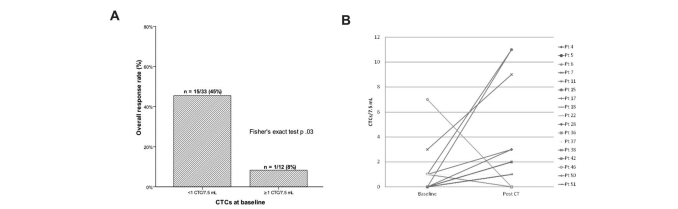
图5:化疗前后CTCs数量变化与预后关联(引用自PLoS One.2014 Aug 8;9(8))
入组的1位头颈部鳞状细胞癌患者,化疗前基线CTCs数量是3个CTCs,连续4个疗程的化疗后,CTCs数量上升到9个,同期实施的PET-CT所见显示,在左腋下与脊髓部阴影明显增加,预示肿瘤进展未得到控制。调整化疗方案仅一个疗程,CTCs数量从9个下降到5个,充分说明了CTCs即可以作为判断HNSCC预后的指标,又可以预测治疗效果。(图6)
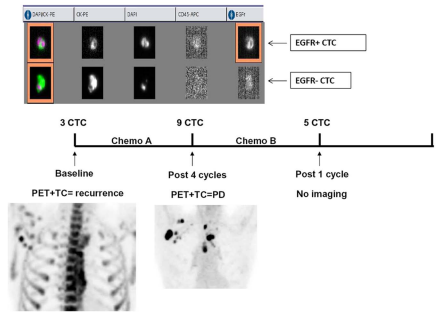
图6:CTCs的数量变化与影像学所见的联合诊断,为修正患者治疗方案提供参考意见(引用自PLoS One. 2014 Aug 8;9(8):e103918)
Bozec等【11】利用Cellsearch系统对49例Ⅲ/Ⅳ期HNSCC患者进行研究时发现,治疗前CTCs的检出率为16%(8/49),NO患者的检出率5%(1/19),N1-2C检出率为23%(7/30),但肿瘤分级之间差异无统计学意义(P=0.012)。治疗(单纯手术或术后联合放化疗)6个月后,13例出现复发或转移,在这13例患者中有2例治疗前检出了CTCs,统计结果提示治疗前与治疗后复发、转移和CTCs的检出没有关系,同时研究还发现CTCs不但与患者的性别、是否有烟酒嗜好、肿瘤位置、肿瘤大小等无关,还与肿瘤的分化程度、肿瘤的分期均无关。但是CTCs数量的多少与患者预后及PFS,OS相关。
4.结语
综上所述,基于外周血CTC检测的对于头颈部肿瘤临床辅助诊断具有重要的临床意义,其应用前景广阔,已成为当前肿瘤临床诊疗的研究热点。CTC的富集模式主要有负向,正向,膜过滤与尺寸分离等模式,检测诊断的主要方法是ICC,iFISH和PCR等。目前CTCs检测的敏感性与特异性对于在其临床应用推广是主要考虑因素,因此进一步提高CTCs检测的敏感性,集成正负向等多种富集技术和高特异性生物标志物检测是下一代液体活检技术的主要特征。通过连续观察CTcs数量的变化情况和下游分析,为监测肿瘤动态,早期发现/诊断肿瘤的复发转移,评估治疗效果或调整治疗方案,为个体化治疗提供全面,实时的信息和新的诊疗思路。
宁波美晶医疗的CTC技术平台的现状及展望
国外的CTC检测公司大部分都有自己独立研发的检测平台或仪器,例如:Cynveniu公司的ClearID微流体平台,Fluxion Biosciences公司的基于微流体技术以及免疫磁珠的IsoFlux系统;宁波美晶医疗技术有限公司拥有一支经验丰富、创新能力强的研发、生产管理和市场推广的人才队伍。公司主要开发“精准医疗”产品并提供相关服务。具体产品包括::
医疗器械方面:自主研发的“CellRich™”循环肿瘤细胞(Circulating Tumor Cells, CTC)检测系统及配套试剂,用于检测血液中的循环肿瘤细胞,进行诊断和监控癌症病情发展。该系统已有8项发明专利获得授权,20多项实用新型和软件著作权授权。项目填补了国内在CTC检测仪器方面的空白,获得了2014年“国家重点新产品”称号。作为同类别中的首创产品,美晶医疗也牵头制定了相关医疗器械分类标准(分类编码6841)。目前“CellRich™”系统已经在包括美国达特茅斯医学院及上海胸科医院在内的国内外多家知名医院投入使用。
检验服务方面:满足“精准医疗”对基因检测的需求,设立了美晶医学检验所,已获得卫生部颁发的医疗机构执业许可证书和临床PCR实验室资质。目前美晶医学检验所已开展临床细胞分子遗传学等检验服务,包括个性化用药基因检测,循环肿瘤细胞检测,疾病风险基因检测等多项业务。业务范围覆盖华东,华南地区,已在上海,杭州等地设立了区域营销中心。
液体活检与医学影像学诊断互补融合对于肿瘤精准诊疗具有重要临床意义, 随着液体活检技术的不断成熟,快速精确筛选和分析血液中完整的循环肿瘤细胞,由肿瘤细胞释放出的外泌体,和循环肿瘤DNA(ctDNA)等生物标记物,并与下游基因诊断相结合,将有力推动先进的分子诊断技术在个性化医疗中的应用。
参考文献:
1:Alvi A;Johnson JT.Development of distant metastasis after treatment of advanced-stage head and neck cancer.Head Neck. 1997 Sep;19(6):500-5
2:Teo PM,Kwan WH,Lee WY,Leung SF,Johnson PJ. Prognosticators determining survival subsequent to distant metastasis from nasopharyngeal carcinoma.Cancer. 1996 Jun 15;77(12):2423-31
3:Abati A,Liotta LA.Looking forward in diagnostic pathology: the molecular superhighway.Cancer. 1996Jul 1;78(1):1-3.
4:Steinert G1,Schölch S,Koch M,Weitz J.Biology and significance of circulating and disseminated tumour cells in colorectal cancer. Langenbecks Arch Surg. 2012 Apr; 397(4):535-42.
5:Funke IandSchraut W. Meta-analyses of studies on bone marrow micro- metastases: an independent prognostic impact remains to be substantiated.J Clin Oncol. 1998 Feb;16(2):557-66.
6:Pajonk F,Schlessmann S,Guttenberger R,Henke M.Epithelial cells in the peripheral blood of patients with cancer of the head and neck: incidence, detection and possible clinical significance.Radiother Oncol. 2001 May; 59(2):213-7.
7:Mangano A,Lianos GDandDionigi Get al.Circulating tumor cells as biomarkers of head and neck squamous cell carcinoma: an updated view.Future Oncol. 2015;11(13):1851-3.
8:Schmidt H,Kulasinghe AandPunyadeera C.A liquid biopsy for head and neck cancers.Expert Rev Mol Diagn. 2016;16(2):165-72.
9:Jatana KR,Balasubramanian PandChalmers JJ.Significanceofcirculating tumor cellsinpatientswithsquamous cell carcinomaof thehead and neck:initialresults.Arch OtolaryngolHead NeckSurg. 2010 Dec;136 (12):1274-9.
10:Grisanti S,Almici CandBerruti Aet al.Circulating tumor cellsinpatients with recurrent or metastatic head and neck carcinoma: prognostic and predictive significance.PLoS One. 2014 Aug 8;9(8):e103918.
11:Bozec A, Ilie M and Hofman P.Significance of circulating tumor celldetection using the CellSearch system in patients withlocally advanced head and neck squamous cell carcinoma. Eur Arch Otorhinolaryngol. 2013 Sep; 270(10):2745-9.
作者简介:
乐飚博士:宁波美晶医疗技术有限公司研发总监。日本名古屋大学工学博士,12年日本肿瘤临床与研究经历,擅长基于纳米技术的肿瘤早期诊断与治疗的放射性医药品研发及分子诊断,曾获得2001年度,日本生物工学学会第一届优秀论文奖等荣誉,入选2012年度上海市浦江人才,主持重大科研项目5项,参与或协助主持科研项目数十项,发表多篇SCI论文。
宋毅:宁波美晶医疗技术有限公司基因检测服务部经理。浙江师范大学理学硕士,7年的临床基因检测工作经验,目前主要带领部门开展相关临床检测服务,及开发CTC下游基因检测项目。
邬振华:宁波市李惠利东部医院胃肠外科副主任医师,外科学硕士,1998年毕业于第二军医大学海军临床医学系,长海医院普外研究生,长期从事胃肠外科临床、科研工作。浙江省抗癌协会胃肠道间质瘤专业委员会委员,宁波市胃肠道间质瘤专科门诊负责人,系中国癌症基金会(索坦)、中华慈善总会(格列卫)项目注册医师。
郝敬铎:宁波第七医院副院长,副主任医师,医学硕士,镇海区“121人才”培养对象,镇海区外科后备人才,镇海区大外科质控中心秘书,宁波市中西医学会肿瘤分会委员,宁波市医学会肛肠分会后备委员,曾赴上海肿瘤医院、奥地利LKH医院进修学习,能够熟练将腹腔镜技术融入到消化外科(胃肠、肛肠、肝胆胰)领域,对于各类肿瘤的综合治疗(化疗、免疫、靶向)有独到见解。多项科研课题获厅局级、市区级立项,曾获“宁波市优秀团干部”“镇海区十大杰出青年”“镇海区科普大使”等荣誉。
沈挺博士:宁波美晶医疗技术有限公司总经理,入选浙江省“千人计划”。 作为主要项目及团队负责人开发的“新一代癌症血液检测生物芯片及系统”项目,获得了中国科技创业计划大赛项目组一等奖,中国首届创新创业大赛优秀企业奖,宁波市首批市“3315计划”海外高端创业创新团队最高奖A类,宁波市发明创新大赛奖,及国家科技部中小企业技术创新基金的立项。本科毕业于清华大学自动化系,2004年获美国斯坦福大学(Stanford University)管理科学与工程博士学位。具备丰富的工程技术研究,高新技术产业化和国际化企业管理的经验与背景。善于团结带领团队,整合资源,带领公司不断创新,开拓业务。
张晓晶博士:宁波美晶医疗技术有限公司董事长。入选国家第二批“万人计划” 科技创新领军人才,科技部中青年科技创新领军人才,浙江省“千人计划”,美国医学和生物工程研究院院士(AIBME Fellow),获得美国国立卫生院(NIH)院长创新研究奖。毕业于美国斯坦福大学,回国创业前任美国著名常春藤盟校(Ivy League)之一的达特茅斯学院(Dartmouth College)正教授, 任生物医学微纳米型器件实验室主任。学术休假期间,曾任美国美国斯坦福大学访问教授,上海交通大学 “王宽诚”讲席教授。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发