《Cell》!麻省理工张锋教授遭遇最强竞争对手!革命性突破!基因编辑超强新成员横空出世取代RNA干扰技术
| 导读 | Cas13a尽管吸引了众人的目光,然而,却不想突然蹦出一个它的孪生兄弟:Cas13d,来和它一争高下。 |
纵观如今已经取得爆发式增长的基因编辑领域,最火热的除了Nature十大人物、著名华裔科学家哈佛大学David Liu团队开发的单碱基编辑技术(Base Editing)以外,另一CRISPR-Cas家族的明星分子-Cas13a绝对榜上有名。
Cas13a尽管吸引了众人的目光,然而,却不想突然蹦出一个它的孪生兄弟:Cas13d,来和它一争高下。

▲美国Salk研究所的研究者们在《Cell》杂志上发表的这篇重磅文章(图片来自CellPress)
3月15日,一组来自美国Salk研究所的科学家团队在国际著名学术期刊《Cell》在线发表一篇基因编辑重磅文章,研究者们从黄色瘤胃球菌(Ruminococcus flavefaciens)等分离出一种CRISPR-Cas蛋白新成员,能够有效地精准靶向降解RNA,研究者们把它叫做Cas13d,其对基因的干扰效率能够达到97%,有望取代RNA干扰技术【1,2】。
▶RNA编辑时代来临◀
自从Cas13a这一具有RNA编辑功能的独特分子被发现之后,整个基因编辑领域的战火就从基于Cas9的DNA编辑领域燃烧到了基于Cas13a的RNA编辑领域。
甚至有科学家在最近惊呼,RNA编辑时代已经来临【3】!

▲《自然-生物技术》上面最近一篇文章惊呼靶向RNA的基因编辑已经来临
确实,Cas13a具有独特的RNA酶结构域HEPN,能够在向导RNA(sgRNA)的带领下精确地靶向降解RNA。
▶大牛的竞争◀
靶向RNA的基因编辑技术是怎么火爆起来的?
这恐怕与基因编辑领域的两位大牛,麻省理工大学著名华人科学家基因编辑领域的先锋人物张锋(Zhang Feng)博士和加州大学伯克利分校的杜德拉(Jennifer A. Doudna)教授,对于Cas13a应用于基因检测领域的竞争有巨大关系。

▲Jennifer A. Doudna(左)和张锋(右)
实际上,最早在2015年,著名的Broad研究所的张锋实验室通过比对class2型的蛋白序列,发现Cas13a与众不同,推测Cas13a具有RNA酶活性【4】。
而他们进一步在2016年4月就在《科学》杂志上面报道了Cas13a是一个RNA介导的RNA酶【5】。
然而,戏剧性的是,竞争对手杜德拉教授则是在短短几个月之后,就在《Nature》上面发表相关文章,证明Cas13a具有两种RNA酶活性,并且首次将Cas13a应用于基因检测。只不过,当时杜德拉实验室的检测灵敏度仅能够达到nM级别,没有实际应用价值而没有进一步开发【6】。

▲位于美国Boston著名的Broad研究所(图片来自Broad Institute)
然而,张锋团队利用等温扩增技术(RPA)结合Cas13a,结果极大地提高了检测基因突变的灵敏度,并于2017年4月在著名学术期刊《科学》杂志发表了基于Cas13a蛋白的Sherlock技术,轰动了世界,使基于Cas13a的基因检测技术具有了实际应用价值【7】。
而就在一个月之前,这两位再次展开激烈竞争,国际著名期刊《科学》杂志在2月15日同时在线发表两篇重磅文章【8.9】,一篇为麻省理工著名学者张锋实验室的关于升级版基因突变检测技术“Sherlock V2”,也主要是基于Cas13a;另一篇则为加州大学伯克利分校的杜德拉教授团队开发的基于Cpf1改造的新的极度灵敏的基因突变检测技术。
▶半路杀出个程咬金◀
正当两位基因编辑领域的领头人物在靶向RNA的基因的基因编辑技术开发方面斗得火热之时,却不不曾想到半路杀出个程咬金来。
这个程咬金就是:Cas13d。
这就像武侠小说里面经常出现的情节一样,刚开始两个高手在那里比武争夺武林盟主的位置,打得不可开交,结果突然出现一个神秘的黑马式的人物,直接就把两个先前争的不可开交的高手直接秒杀,当上了武林至尊一样。这个Cas13d恐怕就是那个黑马。

▲著名的Salk研究所一景(图片来自Salk Institute)
3月15日,一组来自美国Salk研究所的科学家团队在国际著名学术期刊《Cell》在线发表一篇基因编辑重磅文章,分离出一种CRISPR-Cas蛋白新成员,属于Type VI-D型,叫做Cas13d,其能够有效地精准靶向降解RNA,在很多方面显示出比Cas13a更加强大的功能。
研究者们是怎么分离到这个Cas13d的呢?毕竟这茫茫的细菌世界太庞大,要找到与此前有所不同的CRISPR-Cas蛋白如同大海捞针。

▲这篇《Cell》重磅文章的部分作者,站在正中间的这位穿黑衣服的眼镜小哥就是文章的通讯作者Patrick D. Hsu博士(图片来自Salk Institute)
无他,只不过是通过已知的CRISPR-Cas基因寻找未知的基因,即通过生物信息学分析分析细菌基因组中已知的Cas基因序列附近的序列(因为细菌要对抗噬菌体的进攻,一般都是一簇基因集体协作完成,因此具有类似功能的基因在基因组位置上相互离得不远),然后通过序列比对寻找新的Cas基因。
▶d大于a◀
新发现的Cas13d蛋白的功能可能明显要比此前Cas13a强大。
尽管Cas13d与此前的Cas13a均具有两个RNA酶活性结构域HEPN序列,然而,除此之外,它们的其他序列则完全不同,因此,研究者们根据这一点就将Cas13d归类到新的Type VI-D型Cas蛋白家族里面。
Cas蛋白非常多,容易混淆,让部分读者朋友常常感到迷惑,太乱太杂,分不清谁是谁,我们在这里稍微科普一下CRISPR-Casa蛋白的分类。
实际上根据发挥作用的效应蛋白的数量可以分成两大类,即Class1和Class2;Class1发挥酶作用的蛋白需要很多协作一起发挥酶切作用,而Class2类的Cas蛋白,仅需要一个蛋白就够了,比如Cas9,cpf1以及Cas13a,都是一个蛋白质就能够发挥剪切作用。其中,90%的Cas蛋白都是属于Class1,而Class2则只占10%左右,尽管Class2类的Cas蛋白少,然而却是基因编辑技术的基础。
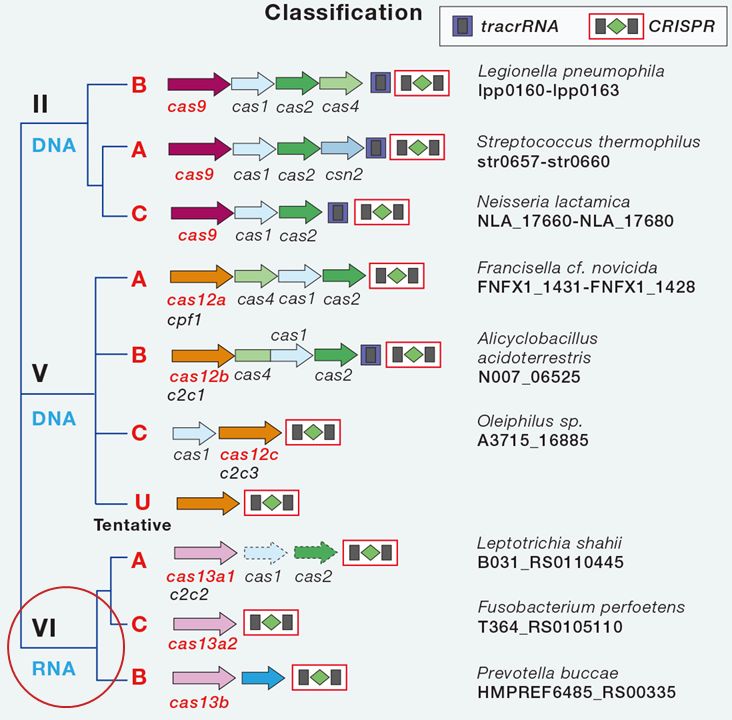
▲Class2类的Cas蛋白分为II、V及VI型,其中Cas13a以及新发现的Cas13d均属于Class2类中的Type VI亚类(图片来自CellPress)【10】
而Class2类的Cas蛋白分又可以根据剪切底物(DNA或者RNA)的不同而分为II、V及VI型,其中Cas13a以及新发现的Cas13d均属于Class2类中的Type VI亚类。
那么,新发现的Cas13d究竟比起其“孪生兄弟”Cas13a强大在哪里呢?或者说具有哪些优势呢?
首先,Cas13d对于PFS序列(protospacer flanking sequence,PFS;相当于Cas9针对DNA的PAM序列)没有偏好,极大地增加了Cas13d的应用范围。
其次,Cas13d的氨基酸只有930个左右,大大于其他的Cas13a的约为1250个氨基酸(见下图),这为Cas13d装载到目前基因治疗最重要的载体之一腺相关病毒载体(AAV)上应用于基因治疗提供了巨大方便,因为AAV的最大装载容量大约只有4.7KB左右,其他的比如Cas13a已经达到AAV病毒装载的极限。
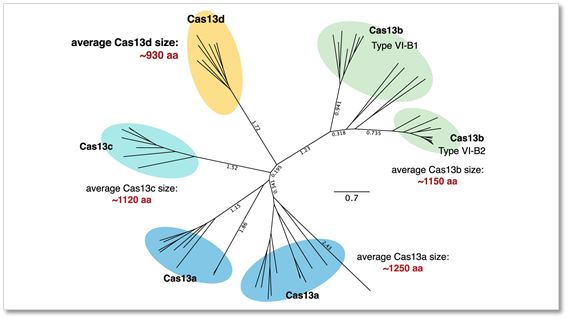
▲Cas13d只有930个氨基酸左右(黄色部分),而其他的Cas13蛋白则均大于1100个氨基酸,这极大地限制了它们应用于基因治疗(图片来自CellPress)
第三,就是下面即将要讲的利用Cas13d来抑制细胞中的RNA表达的效率远远大于常规的基于shRNA的RNA干扰以及基于Cas13a抑制方法。
▶RNA干扰终于可以退休了◀
靶向RNA的基因编辑技术的一大应用就是用于降解RNA或者说抑制细胞中RNA的表达,而基于Cas13d的RNA沉默技术,其效率远远高于常规的shRNA技术和基于Cas13a抑制RNA表达的方法。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发