4款PD-1在华上市“提速”,恒瑞、信达、君实争夺领跑权!
| 导读 | 第二十八批拟纳入优先审评的药品名单共24个新药入选,最引人瞩目的,还要属4款PD-1单抗,特别是其中的3款本土产品。 |
免疫疗法落地中国的日子不远了。
4月23日,药品审评中心(CDE)发布第二十八批拟纳入优先审评的药品名单。(翻至文末,查看详单)此次共24个新药入选,不乏恒瑞医药的10亿品种甲苯磺酸瑞马唑仑,世贸天阶制药的注射用替奈普酶,以及各界期盼已久的九价HPV疫苗等重磅产品。但,最引人瞩目的,还要属4款PD-1单抗,特别是其中的3款本土产品。

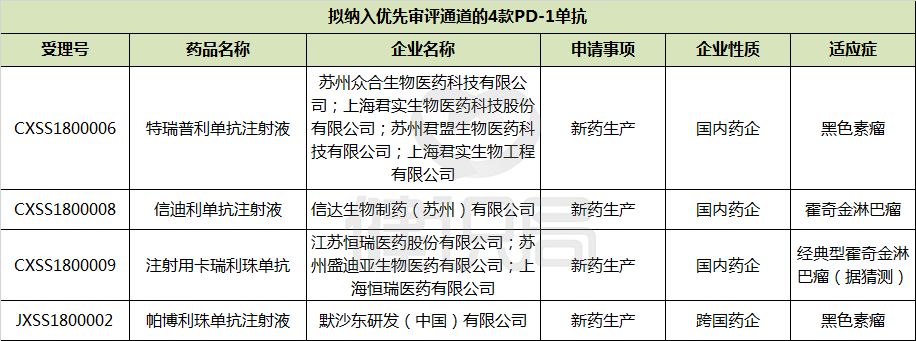
从上述表中可以看到,目前所有在中国递交上市申请的5个PD-1/PD-L1药物中,除申请适应症为二线非小细胞肺癌的百时美施贵宝Nivolumab注射液外,其余1个进口品种、3个本土品种均已站到“绿色通道”入口。
这不仅意味着,免疫疗法即将登陆我国,更意味着国内抗肿瘤药市场将发生一场巨大的变革。
政策扶持
20余PD-1/PD-L1药物申请注册

PD-1/PD-L1药物,作为肿瘤免疫治疗新药,其本身并不能直接杀伤癌细胞,而是通过激活病人自身的免疫系统来抗癌,被认为是抗肿瘤治疗的“杀手锏”,以治愈率和价格双高著称。
从第二十八批拟纳入优先审评名单中也可以看出,研发能力一直远不及跨国外企的本土企业,在PD-1/PD-L1药物研发中,体现出了超强爆发力。据业内不完全统计,由国内企业提出药品注册申请的PD-1/PD-L1药物,已有20余种。
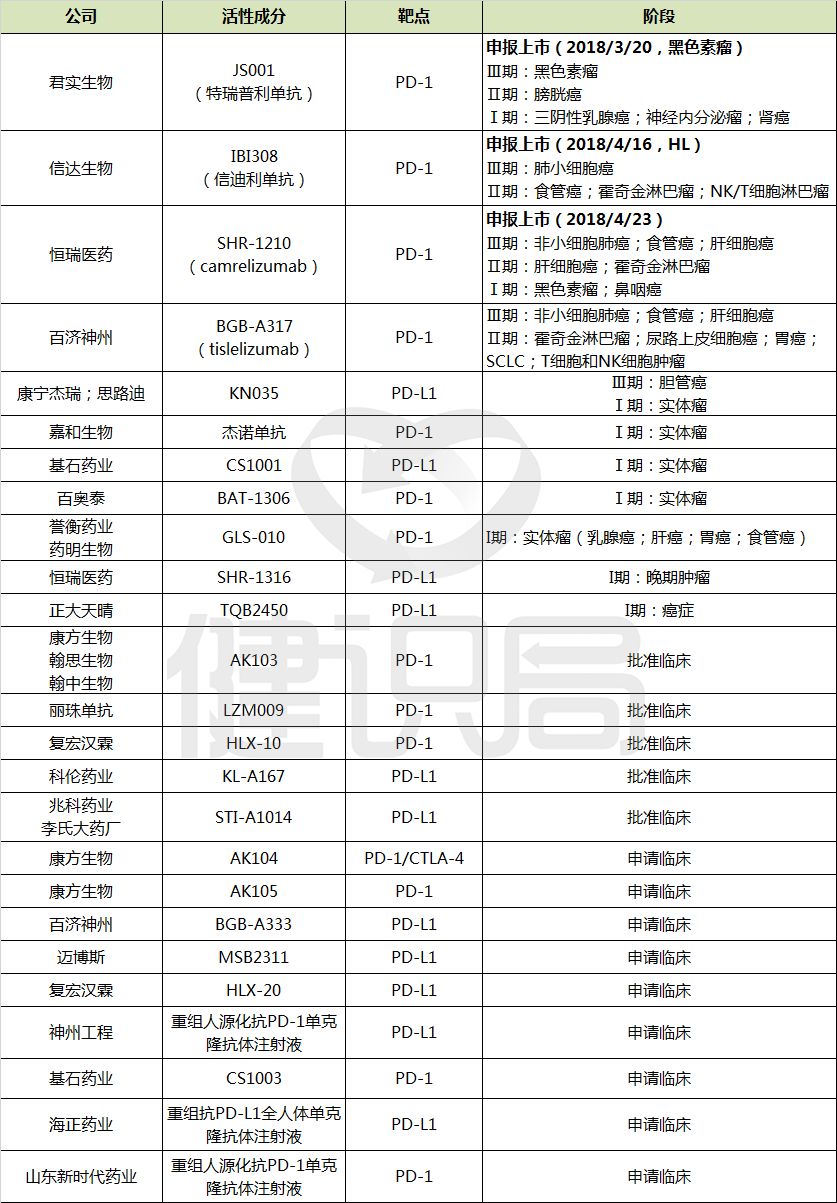
而在全球范围内,目前也只有5个此类药物上市,分别是2014年上市的百时美施贵宝Opdivo、默沙东Keytruda、2016年上市的罗氏的Tecentriq、2017年上市的阿斯利康Imfinzi和默克/辉瑞的Bavencio。
对于本土PD-1/PD-L1的繁荣,业界人士纷纷感慨:“PD-1的药物要成大白菜了吗?”、“恭喜中国成为肿瘤免疫领域第一强国!”


“白菜”也罢,“免疫强国”也罢,不争的事实是,在各项政策鼓励下,本土企业已非常乐于将资金投入到研发中。
而实际上,除了两办此前发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》外,针对PD-1/PD-L1,CDE今年初,还发布了《抗PD-1/PD-L1单抗品种申报上市的资料数据基本要求》。文件允许企业以ORR的替代终点提交上市申请,允许企业以滚动申请形式分阶段提交临床数据,为企业提供了极大便利,也是促成如此多企业参与研发的动因之一。
市场变革
大批抗肿瘤药未上市即遭淘汰?

面对曾经遥不可及的免疫疗法,也遭国内企业扎堆研发的现状,有网友表达了担忧:“蛋糕就那么一块,这么多厂家分,饿死一大批要?”。

也有人指出,临床能过,生产能批,但是最后还是要看市场。“毕竟产品效果和销售,都得溜溜。”

PD-1/PD-L1的内部竞争自不必说,默沙东、恒瑞医药、信达生物、君实生物早已剑拔弩张。
从“开战”已久的国际市场看,谁先上市,谁将占据主动权。从2017年第三季度销售情况看,2014年较早上市的百时美施贵宝Opdivo、默沙东Keytruda的销售额都遥遥领先,均超过12亿美元。
而伴随着细胞疗法、免疫疗法的相继上市,业界担心的一幕,也即将上演——那些正在研发、刚刚上市的靶向抗肿瘤药,特别是大批的me-too、me-better产品,要如何对抗科技进步带来的挑战?(详情>>《贝达、恒瑞胜券在握,靶向抗肿瘤药“淘金潮”将尽?!》)
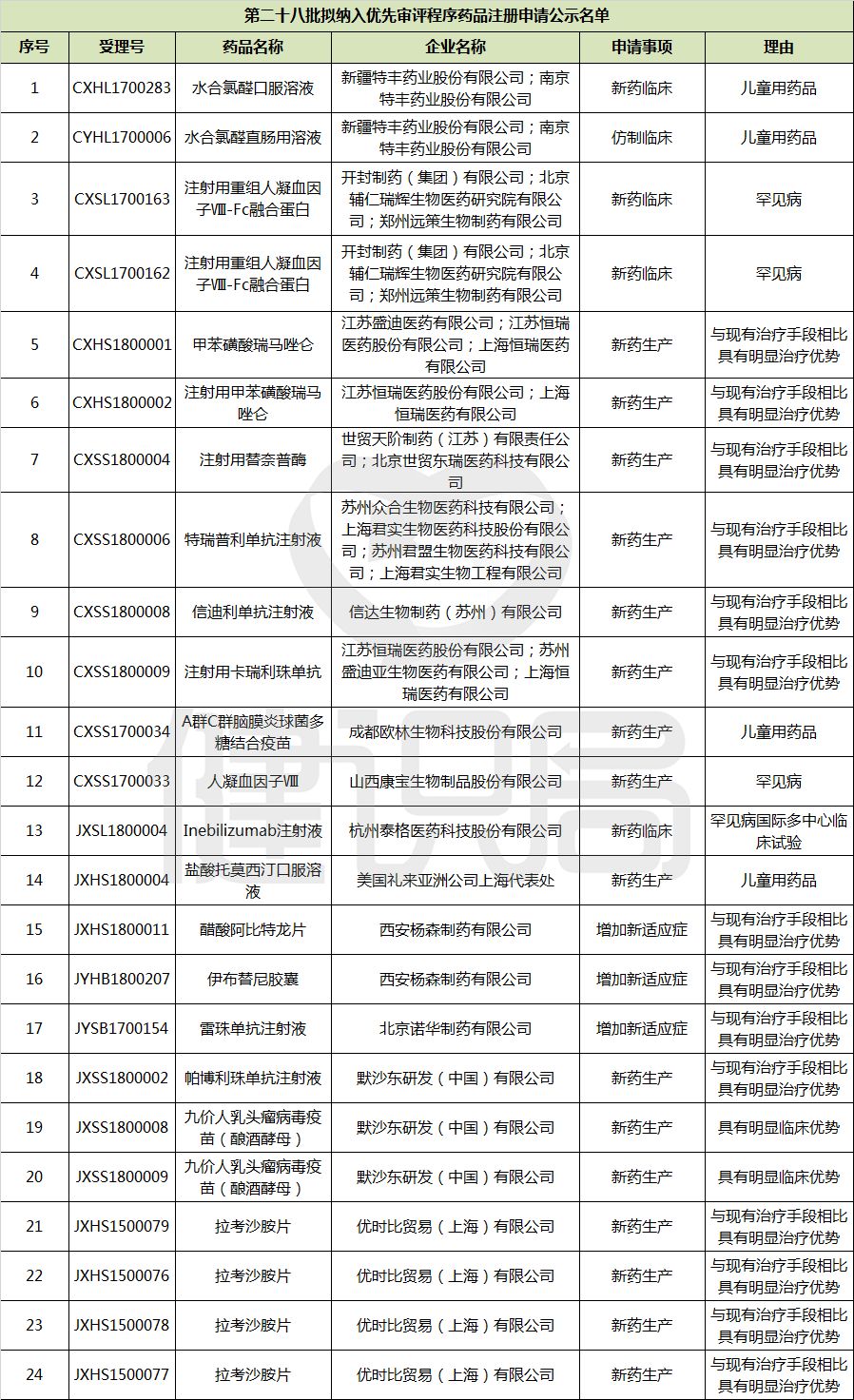
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发