Nature长文:构建人源化的小鼠模型
| 导读 | 小鼠常被用于研究癌症,但科学家仍在努力改善这一模型,以更好地研究人类疾病。基因编辑的进步使研究人员能够构建更能反映人类疾病的小鼠模型。 |
小鼠常被用于研究癌症,但科学家仍在努力改善这一模型,以更好地研究人类疾病。基因编辑的进步使研究人员能够构建更能反映人类疾病的小鼠模型。
本文转载自“生命奥秘”。
1915年,全球处于战争状态,日本病理学家Katsusaburo Yamagiwa和他的助理Koichi Ichikawa正在努力研究一个致命武器,其杀伤力堪比西线战场的战争。这个来自东京大学(Imperial University)的二人组花了150多天把煤焦油涂在兔子的耳朵上。最后,他们发现兔子罹患了肿瘤。
Yamagiwa的兔子模型被认为是第一个用于癌症研究的动物模型。自此,科学家使用了包括细胞系、基因工程小鼠在内的多个模型来模拟人类癌症。但为解答特定实验问题而选择模型时需要考虑多个因素。
据马萨诸塞州波士顿丹娜法伯癌症研究院(Dana-Farber Cancer Institute)的医学肿瘤学家David Weinstock表示,什么样的模型是一个好的癌症模型“是一个非常复杂的问题,最简单的答案是它必须能够给我启发——真正回答我想问的问题。如果不能,那就是在浪费我的时间”。
对于美国国家癌症研究所(US National Cancer Institute, NCI)的部门负责人Nancy Boudreau来说,模型与人类癌症的相似度至关重要。她表示,模型越能体现人类疾病的发生和发展就越好。理想的癌症模型应该能够反映人类癌症发生的许多特征,包括如何应对免疫系统、如何转移,或从其主要来源扩散到身体的其它部位,以及如何对治疗产生响应。这需要科学家了解每种癌症模型的优缺点,因为没有哪个模型能够解答所有问题。
一些证据表明,尽管有很多选择,但现有的癌症模型还不足以开发疗法。国际生物技术创新组织(Biotechnology Innovation Organization)审查了从2006年至2015年的临床试验,结果发现,在针对15种疾病组别的临床试验中,癌症药物的失败率最高,在通过临床1期的癌症药物中,最终获得批准的比例仅为5.1%。相比之下,血液学和传染病药物的临床试验成功率分别为26.1%和19.1%。
德国癌症研究中心(German Cancer Research Center)的血管肿瘤专家Hellmut Augustin指出,如果更好的临床前模型可以将临床转化率提高10%,这将极大地提高临床前癌症研究的质量,并为药物开发者节省巨大开支。
研究人员一直为改进现有模型做出了诸多努力。他们在全球范围内展开合作,希望改善这些模型。例如,NCI、英国癌症研究所(Cancer Research UK)、英国维康信托桑格研究所(Wellcome Trust Sanger Institute)和荷兰乌得勒支的非营利性组织Hubrecht Organoid技术公司联手开展了一项名为人类癌症模型倡议(Human Cancer Models Initiative)的计划。该倡议于2016年启动,目标是在细胞系中开发1000种新型癌症模型,以供全球研究人员使用。这些项目表明,许多科学家都认同扩大癌症模型库的价值。
1修饰小鼠基因组
一般情况下,细胞株都可以帮助我们解决很多研究难题。但这些细胞通常以2D形式生长,缺乏人类癌症生长,尤其是免疫系统生长的正常条件。这使培养的细胞不适合模拟癌症的多个特征。NCI的癌症系统生物学家Shannon Hughes指出,相比之下,基因工程小鼠(genetically engineered mouse, GEM)适用于多个研究。它们能更好地模拟人类癌症特征,并且容易操控。
多年来,基因工程小鼠需要复杂的过程来产生所需的DNA,在培养基中转化细胞,然后将其注入到小鼠胚胎,以修饰小鼠的基因。但是,与大多数其它遗传修饰应用一样,现在制作GEM的方法随着CRISPR基因编辑系统的问世而获得改进。纽约威尔康奈尔医学院(Weill Cornell Medical College)的癌症生物学家Lukas Dow表示,CRISPR可以完成一些非常精细的、以前无法完成的操作。例如现在诱导大型染色体重组,如反转、缺失和易位的技术已经比较简单直接了。但有了CRISPR后,科学家甚至可以精确改变啮齿动物的DNA中的一个碱基。他指出,这种技术还可以清晰到让每个碱基的分辨率准确再现科学家在人类癌症中观察到的精确突变。以前的癌症模型都忽略了这些细节,但是病因往往就在这些细节里。
韩国基础科学研究所(South Korea’s Institute for Basic Science)的基因组工程师Taeyoung Koo等人使用CRISPR靶向一个非小细胞肺癌(non-small-cell lung cancer, NSCLC)突变。他们报告指出,15%的人类NSCLC病例涉及表皮生长因子受体(epidermal growth-factor receptor, EGFR)基因中仅一个DNA碱基的改变(即单核苷酸突变)。目前治疗方案主要是使用靶向该基因的突变蛋白的药物,例如gefitinib。
Koo的团队开发了CRISPR-Cas9向导RNA序列,该序列识别最常见的EGFR突变区域(这种突变占EGFR突变相关NSCLC病例的40%以上)。然后他们将人类NSCLC肿瘤植入小鼠,并用CRISPR-Cas9和特定的向导RNA靶向突变。结果显示,设计合理的向导RNA能准确地打断致病序列,产生治疗效果。他们报告称,Cas9酶可以有效区分EGFR突变型等位基因与野生型等位基因,从而破坏致癌基因,诱发癌细胞死亡。
Dow提醒,虽然CRISPR具有显著的靶特异性,但其切割结果高度多变。因此,如果目标是在所有病例中都产生一致的遗传变化,那么Cas9之类的核酸酶就不是一个好选择了。传统CRISPR系统中DNA修复的随机性意味着,你需要面对细胞异质性的问题。
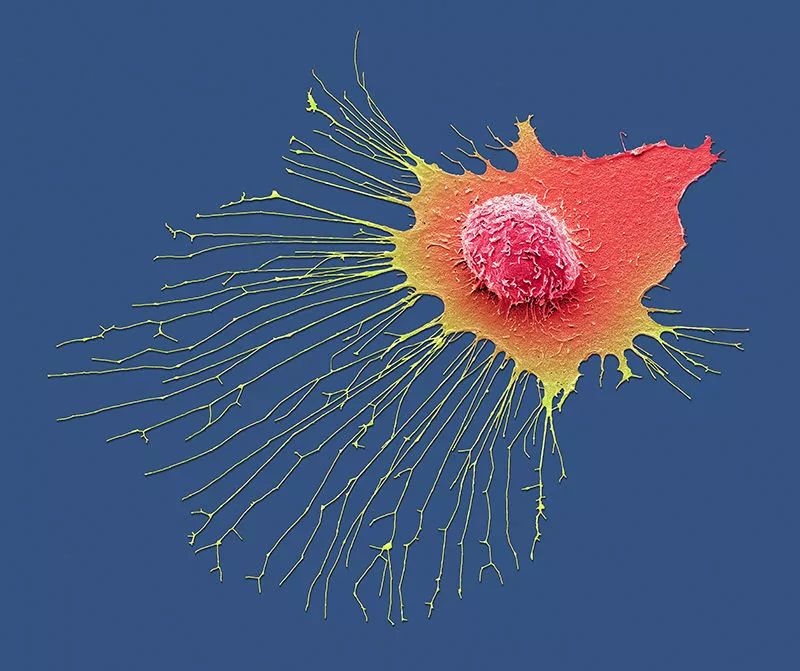
一个乳腺癌细胞在显微镜下迁移。
GEM有其局限性,特别是在疾病的发展时间和异质性方面。据Hughes解释,小鼠肿瘤发展非常快,从而迫使研究人员加快他们的实验进度,但这与人类疾病的发展速度大不相同。此外,小鼠肿瘤往往过于同质,而无法正确反映人类疾病:GEM通常只包含一两个基因改变,而人类肿瘤通常有很多基因改变。
为了解决缺乏异质性的问题,并产生更忠实于人类癌症的模型,德州大学安德森癌症中心(University of Texas MD Anderson Cancer Center)的生物医学科学家Lorenzo Federico等人在系统生物学家Gordon Mills的实验室里展开研究,设计了一系列来自转基因小鼠原发乳腺肿瘤的可移植细胞系。最后他们得到了12个新的小鼠移植细胞系——可以可靠地产生具有一系列突变的特定类型的肿瘤小鼠模型。Federico表示,理想的情况是,不同小鼠发生的不同原发性肿瘤应具有不同的分子改变,以更忠实地反映人类癌症的遗传特征。
这些模型已被用于靶向治疗(包括癌症分子途径抑制剂)的临床前评估。根据Federico的说法,这些模型也非常适合研究免疫系统在肿瘤发生和治疗发展中的作用。然而,他指出,由于这些移植物来源于基因工程小鼠肿瘤,对于得到的结果,“我们需要保持谨慎”。
癌症如何发生和发展,取决于它与宿主免疫系统的相互作用。其中一些最有希望的治疗方法是免疫疗法,它通过激活患者的免疫系统来攻击特定的肿瘤。为了研究这些疗法,科学家需要具有完整免疫系统的小鼠——最好是具有人类的免疫系统。这就需要人源化的小鼠模型。
为了让GEM拥有人的免疫系统,科学家要将人造血干细胞(多种血细胞的前体细胞)植入免疫缺陷的小鼠体内。这一过程重现了人体免疫系统的某些方面,例如负责攻击外来细胞的白血球。然后,研究人员便可以将人类肿瘤样本(病人源性肿瘤异种移植物,patient-derived xenograft, PDX)移植到小鼠体内,创建更真实的人类疾病模型。
根据Augustin的说法,PDX模型越来越受到药物开发者的欢迎。药物开发商将PDX用作药物测试的试验基地。PDX模型也开始进入基础研究实验室,并且可以在市场上购买到。缅因州巴尔港的杰克逊实验室(Jackson Laboratory)与超过20家癌症诊所合作,创建了450多种这类小鼠模型,其中包括急性骨髓性白血病和膀胱癌、乳腺癌、肺癌、卵巢癌和胰腺癌。Jackson实验室表示,这些小鼠的成本通常是标准免疫缺陷小鼠的三倍。
科学家也可以开发自己的PDX小鼠模型。圣裘德儿童研究医院(St. Jude Children’s Research Hospital)的肿瘤学家Elizabeth Stewart等人使用手术切除的、能反映大脑、骨骼和其它癌症的小儿实体瘤样本,构建了67个PDX小鼠模型,这覆盖了十多种肿瘤类型。
Stewart等人的目标是创建模型来研究针对不同肿瘤类型的药物的治疗效果——这需要模型准确地代表原始疾病。Stewart的研究小组决定使用全基因组和全外显子DNA测序技术,从核酸水平上比较PDX和原始肿瘤。他们发现,总体而言,PDX的DNA序列在很大程度上与原始肿瘤的基因组特征相匹配,但也出现了新的突变。据研究人员总结,PDX“保留了患者肿瘤的分子和细胞特征,以及其发育起源的表观遗传特征”。
这并不是说PDX是静态的。哈佛-MIT博德研究所(Broad Institute of Harvard and MIT)的所长Todd Golub及其研究小组研究了代表24种癌症的543个PDX模型中的拷贝数变异(copy-number variations, CNV)。他们发现, 原始小鼠1次传代后,60%的PDX中插入了长达500万个碱基的CNV基因扩增区域,4次传代后这个概率是88%。结果显示,最初模仿人类疾病的PDX可以演变成不能模仿人类疾病的形式。当这种情况发生时,PDX便不能再模拟目标癌症了。
Boudreau认为,将人类PDX模型组织移植到人源化小鼠中会得到最有吸引力的一种新癌症模型,但他表示这“尚未完全实现”,因为研究人员尚未掌握技术的细节。据她补充,随着科学家对免疫治疗和肿瘤响应的机制的兴趣的增加,人源化小鼠将会变得非常重要。
2回归原始方法
一些科学家使用Yamagiwa的老方法,而不是基因技术来制造更实用的癌症模型。这种化学致癌方法以普通的实验室小鼠为研究对象,结果可以产生更真实的癌症模型。
据加利福尼亚大学旧金山分校(University of California, San Francisco)的肿瘤生物学家Melissa Reeves解释,用一种致癌物质处理小鼠,就像一种环境因素会造成特定类型的损伤,并获得特定类型的肿瘤,如皮肤肿瘤。这对于模拟由于重复暴露于特定环境的人类肿瘤很有帮助,因为它模拟了由广泛基因损伤引起的肿瘤的自然演变。
化学致癌物质可能会在数百个位点破坏DNA,并且随着时间的推移影响会继续存在。Reeves等人采用这种方法,在小鼠皮肤局部涂抹名为DMBA和TPA的已知致癌物,诱导小鼠发生皮肤癌,进而研究肿瘤如何从原发部位转移至继发部位。她的研究结果表明,皮肤癌不会按顺序从一个位置迁移到另一个位置——例如,从皮肤到淋巴结再到肺,而是“通过平行传播,同时进入淋巴结和肺部”。
Reeves表示,这一成果证实了一个临床发现:去除乳腺癌周围的淋巴结并不总是能够提高生存率,这一观察结果促使研究人员推测平行传播的可能性。
尽管与GEM和人源化小鼠相比,化学致癌作用可能可以产生更好的、类似于人类癌症异质性的肿瘤,但实际上这些模型也存在明显的缺点。通过化学手段诱发原发性肿瘤,然后将其移除并研究转移过程,可能需要18个月。Reeves指出,另外,每个肿瘤都会有所不同。
同样,每种癌症模型都不尽相同,小鼠模型并不总是最好的选择(文末更多阅读:“类器官模型”)。小鼠的饲养费用昂贵,并容易引起伦理问题,这让细胞系不失为一种值得考虑的研究对象。
目前,研究人员只能选择一种最能解答他们问题的模型——尽管存在缺陷。同时,科学家将不断改善现有模型,并开发新模型。正如Augustin指出的那样,“用于开发和使用临床转化率更高的小鼠肿瘤模型的投资非常有意义。”否则,我们可能永远无法提高临床试验中癌症药物的成功率。
3更多阅读:类器官模型
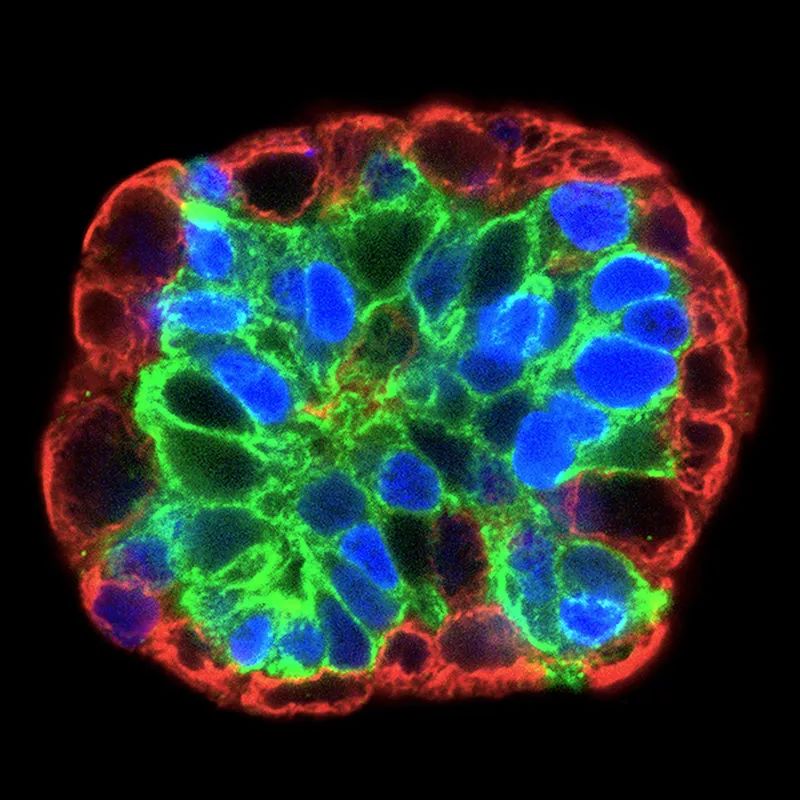
类器官是一种日益流行的模型。
小鼠并不是研究人员模拟癌症的唯一选择。一种流行的新兴替代方法是类器官——模仿一些器官的微观解剖,例如血管系统的3D细胞培养物。
法国奥尔良分子生物物理中心(Centre for Molecular Biophysics)的分子生物学家Claudine Kieda表示,肿瘤就像是一个多种组织合作的器官。3D细胞模型可充分考虑微环境,例如肿瘤周围和内部的氧气水平。
Kieda的实验室将黑素瘤和内皮细胞结合在由胶原蛋白、生长因子和一个名为Matrigel的3D支架组成的基质中。这种混合物允许细胞形成类似于肿瘤及其周围环境,特别是在氧化方面的结构。Kieda指出,每个细胞都在像孵化器那样的环境中工作,氧气的分压远远高于体内。”
此外,类器官对于药物开发也很有价值。例如,英国剑桥大学(University of Cambridge)的组织修复生物学家Meritxell Huch等人创建了用于药物筛选的肝癌类器官。这种类型的肿瘤只有20%的概率能在小鼠身上生长,但Huch实现了近80%的成功率——并且该过程的效率大约是PDX的两倍。Huch表示,速度是主要优势。Huch的研究小组利用这些类器官,开发了一种信号通路抑制剂,以用于治疗原发性肝癌。
与其它癌症模型一样,一个好的类器官要尽可能地忠实地重现人类疾病。美国国家癌症研究所(US National Cancer Institute)的肿瘤转移研究员Nancy Boudreau表示,类器官比细胞更具生物学特性,而且比小鼠便宜。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发