异基因造血干细胞移植后CART治疗的最佳时间窗
| 导读 | 但allo-HSCT后,CART的治疗窗以及治疗的有效性一直是争论的热点.本文主要讨论allo-HSCT后CART治疗的应用,以及allo-HSCT后... |
异基因造血干细胞移植(Allogeneic hematopoietic stemcell transplantation,allo-HSCT)是血液肿瘤的重要治疗手段。然而,allo-HSCT后复发的血液疾病的治疗仍是一个很大挑战,长期生存率较低。嵌合抗原受体T细胞疗法(Chimeric antigen receptor redirected T cells,CAR-T cells)是一种新型疗法,可以诱导复发/难治性血液肿瘤患者疾病缓解。但allo-HSCT后,CART的治疗窗以及治疗的有效性一直是争论的热点。
本文主要讨论allo-HSCT后CART治疗的应用,以及allo-HSCT后复发患者使用CART治疗产生的毒性以及移植物抗宿主病(graft-versus-hostdisease,GVHD)的发生情况。最后,介绍allo-HSCT后复发患者使用CART治疗的临床试验情况以及治疗窗的选择。
异基因CART疗法对allo-HSCT后复发且毒性和并发症少的B细胞肿瘤患者是有益治疗。然而,目前仍需要大样本的多中心临床试验选择合适的治疗窗以证实其有效性。
背景介绍
血液肿瘤allo-HSCT后复发很常见,复发后化疗的缓解率和长期生存率很低。供者淋巴细胞输注是用于allo-HSCT后防止复发的疗法之一,但其对于不同的血液疾病,效果相差甚远。移植后供者源T细胞和NK细胞可以控制白血病,主要机制是通过移植物抗白血病反应(graft-versus-leukemia,GVL)。然而,供者源淋巴细胞、T细胞、NK细胞在预防和治疗allo-HSCT后复发方面有效性有限,还可能导致威胁生命的GVHD。
接受供者淋巴细胞输注治疗的患者中,大概1/3会发生临床上严重的急性GVHD,占治疗相关死亡原因的6%-11%,因此,迫切需要新的治疗手段来提升移植后高风险患者的预后。
嵌合抗原受体CAR是由抗原识别区和T细胞激活域组成的融合蛋白。进行遗传修饰的T细胞可以表达CAR,并输注到患者体内。CART输注到患者体内后提供了一种新的、有前景的基于细胞的免疫治疗,促进并有效维持抗肿瘤的移植物抗白血病反应,且无主要组织相容性复合体(major histocompatibility complex,MHC)的限制。使用CART治疗的患者,其复发难治的血液肿瘤得到缓解,且缓解率高于单抗类药物和其他相关疗法。
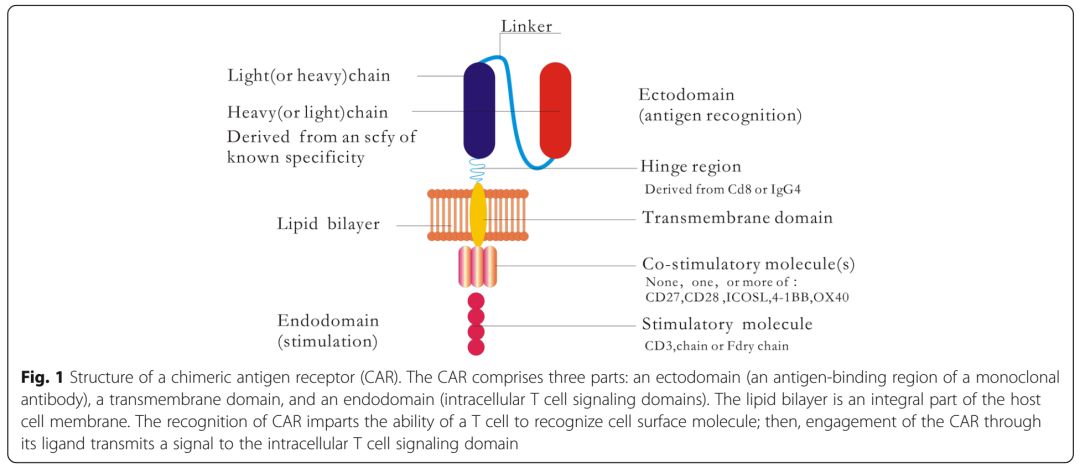
图1 嵌合抗原受体的结构图(来源:Journal of Hematology & Oncology)
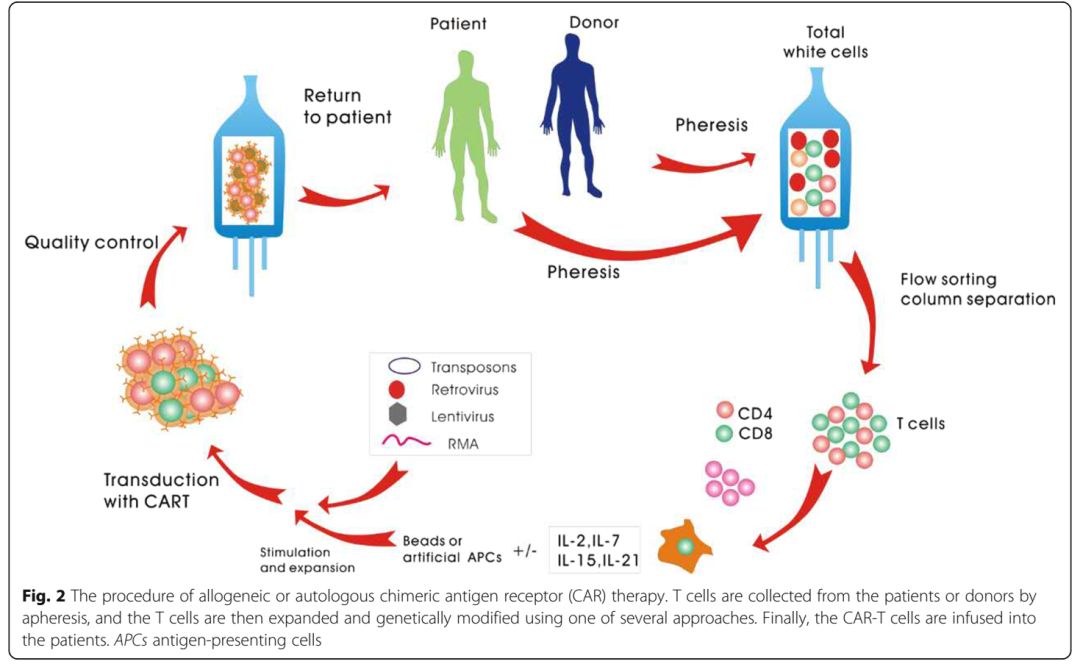
图2 CART治疗流程图(来源:Journal of Hematology & Oncology)
CART治疗allo-HSCT后复发的B细胞恶性肿瘤
降低CART治疗后复发的关键在于T细胞的使用,T细胞可能来源于自体造血干细胞移植后患者本身,也可能来源于allo-HSCT后的供者。T细胞介导的肿瘤识别在白血病控制中起到重要作用,然而,供者淋巴细胞并不能完全清除白血病,导致allo-HSCT的失败。CART治疗后有双重问题:宿主抗移植物反应会清除移植的异体细胞,影响异体细胞的存续时间;同时也存在移植物抗宿主反应。然而,异基因CART能够耐受宿主的MHC,这说明在不影响CART细胞杀伤活性的前提下,异基因反应可能会减弱。
Kochenderfer发表的文献报道了供者源的CD19-28z-CAR-T细胞治疗了10例CD19阳性B细胞恶性肿瘤患者,其经历过allo-HSCT以及至少一次供者淋巴细胞输注治疗,其中包括4例慢性淋巴细胞白血病CLL和6例淋巴瘤(包括2例弥漫大B淋巴瘤DLBCL和4例套细胞淋巴瘤)。这些患者都未出现GVHD,1级急性GVHD和轻度慢性GVHD,除CART治疗外,未接受任何其他抗肿瘤治疗。最后1例接受CART治疗的患者已经缓解超过4周,所接受的CD19-CART细胞数量为0.4×106/kg-7.8×106/kg。CART治疗1个月后,1例CLL患者获得完全缓解(CR),6例患者(1例CLL,2例DLBCL,3例MCL)获得疾病稳定(SD),1例MCL患者获得部分缓解(PR),2例CLL患者疾病进展(PD)。
Cruz发表的文献报道了供者源的CD19-28z-CAR-T细胞治疗了allo-HSCT后的8例B细胞恶性肿瘤患者(4例CLL患者和4例ALL患者),所有患者移植后复发或者处于疾病复发高风险。在6例患者中,移植后进行了多次挽救治疗仍未能控制复发,2例患者CART治疗时处于复发高风险,但仍处于缓解阶段。这些患者在输注前均未进行预处理,输注细胞数量为剂量递增:1.5×107/m2、4.5×107/m2、1.2×108/m2。6例复发患者中有2例显示出了客观抗肿瘤活性,2例复发高危患者仍保持缓解,其中1例CR持续8个月以上,另1例CR持续8周。
Brudno最近发表的文献中,I期剂量递增的临床试验使用CD19-28z-CART细胞治疗B细胞恶性肿瘤(CLL/DLBCL/MCL/ALL各5例患者)。除ALL和DLBCL患者外,其他患者均接受了至少一次供者淋巴细胞输注,所有患者均没有进行化疗和其他类型的治疗。试验排除了有I级急性GVHD的患者和轻度慢性GVHD的患者。allo-HSCT后复发进展的患者接受了1次CART治疗,剂量从106-107/kg。20例患者中有8例获得了缓解,其中6例CR(4例ALL,1例CLL,1例DLBCL),2例获得PR(1例MCL,1例CLL),4例患者疾病进展PD(2例CLL,1例ALL,1例DLBCL),其他患者疾病稳定SD。20例患者的6个月无事件生存率(EFS)为39%,缓解率最高的是ALL,4/5微小残留病灶MRD阴性,1例CLL患者的最长CR持续时间超过了30个月。
另一项研究中,1例11岁ALL女孩allo-HSCT后复发,然后用化疗和淋巴细胞输注治疗仍无进展,随后进行CD19-28z-CART细胞治疗。在输注了1.0×106/kg CART细胞后,获得了MRD阴性。随后进行了3次CART输注(0.83×106-1.65×106/kg),无病生存时间为10个月。
还有一项研究报道了异基因骨髓移植后复发的儿童,对包括blinatumomab在内的多种细胞毒性和生物疗法均无效。随后在进行依托泊苷和环磷酰胺预处理后,接受了CD19-28z-CART细胞治疗(1.4×106/kg)。该患者在CART治疗后获得了CR且MRD阴性,但只持续了1个月,在治疗后2个月疾病进展。
这些研究表明异基因CART治疗allo-HSCT后复发患者有一定的有效性。
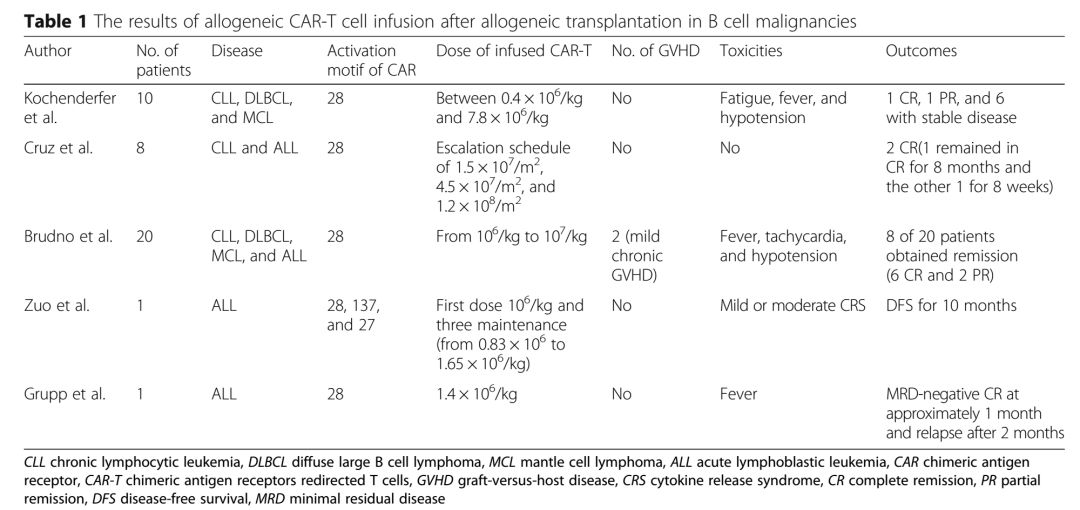
图3 异基因CART治疗allo-HSCT后复发的结果(来源:Journal of Hematology &Oncology)
CART治疗allo-HSCT后复发患者的毒性
CART治疗的毒性主要是细胞因子释放综合症(cytokine release syndrome,CRS),神经毒性,B细胞发育不良。CRS是最常见的毒性,与治疗反应有关,未发生CRS的患者从CART中获益也较少,发生CRS的患者也多获得了缓解。然而,研究也表明,治疗缓解与CRS的严重程度没有很强的相关性。CART细胞输注时肿瘤负荷与严重CRS发生的风险有关,CRS发生过程中sIL2Ra、IL-6、IL-10、IFN-γ的水平显著升高,这是T细胞增殖的结果。CRS的症状有轻度流感样症状,也有多器官衰竭,休克,表现出储铁蛋白水平升高(>10000 ng/ml),肝脾肿大,低纤维蛋白原血症(<150 mg/dL)。
CRS的其他并发症包括神经毒性。最常见的毒性是脑病,可能是自限性的,不用干预在几天内就会得到缓解,也可能持续很长时间。
CART成功治疗的毒性包括B细胞发育不良,低丙型球蛋白血症,需要持续监测。其他毒性包括肺炎、低血压、缺氧、肿瘤溶解综合征、心动过速、疲劳和发热等。
上述allo-HSCT后复发患者接受CART治疗后表现出较好的耐受性,出现了轻度的并发症,包括轻度到中度的CRS,暂时的低血压,心动过速和发热。所有患者都完全恢复,症状和实验室检查结果均恢复正常。
GVHD
GVHD是allo-HSCT后出现的医学并发症,主要因供者T细胞移植到宿主后表现出于宿主组织相容性的差异。这种宿主和供者的差异导致供者T细胞激活,对MHC抗原进行抵抗,引起TNF-a和IFN-γ在内的细胞因子升高。GVHD分为急性和慢性两种类型。在儿童和成年患者中,急性GVHD是allo-HSCT后复发和死亡的主要原因,而表现为细胞因子水平急剧升高的CRS,是CART治疗的主要严重毒性。allo-HSCT后进行CART治疗也会出现急性GVHD,但目前尚无allo-HSCT后进行CART移植引起急性GVHD的报道,只有2例轻度慢性GVHD的报道,低剂量的CART或许可以解释这一点。另一种解释是CART在受者体内耐受,由于CART有较高的抗肿瘤能力,因此较低剂量CART细胞就能够消除肿瘤细胞,而不引发GVHD。
Allo-HSCT后复发患者进行异基因CART治疗的临床试验登记情况
虽然有零星数据证明异基因CART疗法对allo-HSCT后复发且毒性和并发症少的B细胞肿瘤患者安全、有效。然而,仍需要更多的临床试验数据进一步研究CART的作用。目前有3项相关的临床试验,见图4。
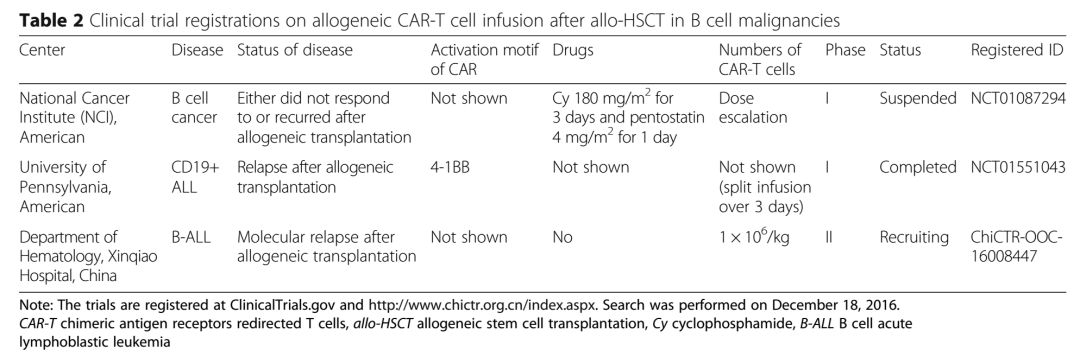
图4 临床试验登记情况(来源:Journal of Hematology &Oncology)
Allo-HSCT后复发患者使用CART治疗的治疗窗
异基因CART在体内会大量增殖,最后消除,这个过程与自体CART细胞类似。虽然,异基因CART在体内大量增殖,报道的GVHD是轻度的引起暂时体重降低,未出现GVHD相关的死亡。这些发现证明,异基因CART可以用于治疗或预防allo-HSCT后的复发。然而,CART输注时间并没有标准。目前的数据说明,所有接受CART治疗的患者都是allo-HSCT后复发或难治的,且接受过化疗或供者淋巴细胞输注。有一些案例是通过严密监测MRD在白血病复发早期来进行CART治疗的。我们的研究中是通过对B-ALL的分子复发的早期监测来进行CART治疗的。
确定allo-HSCT后复发的高危因素或时间对于淋巴恶性肿瘤患者进行CART治疗是一种重要的预后工具。根据对移植后复发高危因素患者的确定、HSCT前后MRD、GVHD的出现等,HSCT后进行早期免疫干预以预防复发的最佳时间窗是移植后55-200天。因此,在HSCT后早期进行CART治疗对淋巴肿瘤allo-HSCT后高危患者减少复发、提高长期生存十分重要。
结论
B细胞恶性肿瘤患者allo-HSCT后对复发疾病的预防和治疗仍然有未满足的临床需求。一些疾病被CART成功治愈且没有发生严重的并发症,然而还需要更多研究来证实。由于细胞治疗的有效性与低肿瘤负荷有关,因此应通过分子或免疫方法监测MRD以进行早期治疗。异基因CART治疗应作为allo-HSCT后的标准治疗。CART输注的最佳时间窗是allo-HSCT后的55-200天。CART治疗应在allo-HSCT后尽快使用或MRD阳性复发后使用。细胞治疗应该被考虑整合到标准治疗中。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发