Science长文丨David Sabatini组关于核糖体自噬的关键发现——林圣彩教授短评
| 导读 | 如果用CRISPR-Cas9技术敲除NUFIP1,那么也会伴随着ZNHIT3蛋白的减少.研究在293T细胞中使用mTOR1抑制剂Torin 1时发现,使... |
自噬(Autophagy)领域虽然已经发了诺奖,但是很多人觉得这个奖发早了,其实该领域还有很多重要问题需要解决,可能正因为奖发早了从而使得很多研究人员赶紧开始换研究方向了,事实上这未必是正确的选择。
根据底物运送的方式区别,自噬一般可以分为大自噬(macroautophagy)、小自噬(microautophagy)和分子伴侣介导的自噬(chaperone-mediated autophagy, CMA)。但是如果根据底物降解的选择性来划分那就非常多了,选择性自噬包括:线粒体自噬(mitophagy)、聚集体自噬(aggrephagy)、核糖体自噬(ribophagy)、内质网自噬(reticulophagy)、细胞核自噬(nucleophagy)、异源吞噬(xenophagy)、溶酶体自噬(lysophagy)、脂滴自噬(lipophagy)、铁自噬(ferritinophagy)等【1】。
今天要关注的话题是核糖体自噬(ribophagy)。
前不久,Science杂志以长文形式发表了一篇美国Whitehead研究所David M. Sabatini组和德国莱布尼茨研究所Alessandro Ori组合作完成的题为“NUFIP1 is a ribosome receptor for starvation-induced ribophagy”论文。该研究发现了由饥饿诱导的核糖体自噬过程中新的核糖体受体分子NUFIP1。该工作对于了解核糖体自噬非分子机制具有重要的意义。

在过去的十年里,我们越来越明显的看以mTORC1和AMPK作为主要代表的能量感受调节器,和溶酶体具有非常亲密的联系。绝大部分mTORC1的上游营养感受器组分分布在溶酶体的表面(最近5年,厦门大学林圣彩组的系列工作主要揭示了溶酶体途径激活AMPK ,并揭示拮抗mTORC1的机制),而溶酶体产生的营养成分通过促进mTORC1迁移,而激活其功能。而mTOR1也可以通过调节自噬小体的形成来调控溶酶体降解过程中的大分子的流动,这一过程可借助TFEB转录因子实现【2】。
在最新的这项工作中,Sabatini研究组运用他们最近刚刚开创的一种名为“LysoIP”的方法迅速分离高纯度的溶酶体【3】,在抑制mTORC1(营养饥饿或者使用抑制剂Torin1)信号传导的条件下,研究了溶酶体蛋白质组的变化。
通过分析在mTORC1抑制条件下的溶酶体蛋白质组的动态变化,一个此前从未报道和溶酶体有关联的蛋白NUFIP1引起了研究人员的兴趣。NUFIP1在mTORC1抑制条件下在溶酶体中积累,而此前它被认为主要定位在细胞核中。
NUFIP1全称为细胞核脆性X智力低下互作蛋白(Nuclear fragile X mental retardation-interacting protein 1),过去的研究表明NUFIP1主要定位于细胞核,但是在某些细胞类型中也有定位在胞质中。NUFIP1能够与ZNHIT3( Zinc finger HIT domain-containing protein 3)形成二源异聚体。如果用CRISPR-Cas9技术敲除NUFIP1,那么也会伴随着ZNHIT3蛋白的减少。
研究在293T细胞中使用mTOR1抑制剂Torin 1时发现,使用抑制剂并没有影响NUFIP1的总量,但是影响了其细胞定位(下图)。
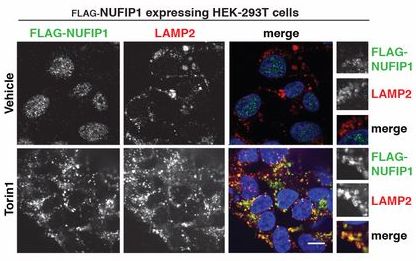
由于抑制mTOR1后会诱导强烈的细胞自噬,于是研究人员猜测NUFIP1-ZNHIT3可能会通过自噬小体转移到溶酶体上。如果敲除ATG7这个自噬小体形成关键蛋白,那么即便是Torin 1处理后也不能看到NUFIP1-ZNHIT3在溶酶体的定位。后续通过分析NUFIP1蛋白序列加上实验验证发现LC3B能与之相互作用,还进一步发现了NUFIP1-ZNHIT3与核糖体的作用依赖于mTOR1的状态,也就是说mTOR1抑制后,NUFIP1-ZNHIT3与核糖体的作用增强了。
回到本文开头提到的核糖体自噬来看问题,接下来不难想象肯定会问营养饥饿状态下诱导的核糖体降解与NUFIP1这个蛋白是否有重要关联。答案是显而易见的,NUFIP1是核糖体自噬所必须的关键蛋白。NUFIP1周期性出入细胞核,在饥饿期间,它从细胞核转移到细胞质,并在细胞质中积累并搭载上它的货物核糖体,它本身通过直接结合在LC3B上,将核糖体运送到自体吞噬泡进行降解。
小结一下,作者研究结果表明,NUFIP1最初并不定位在溶酶体上, 但它是饥饿诱导的核糖体降解所必需的,并且它满足多个作为核糖体自噬受体的标准。但是NUFIP1是否是唯一受体这个并不清楚。而关于核糖体自噬过程,前不久哈佛大学Wade Harper组在Nature Cell Biology上报道,通过系统分析人源细胞中核糖体自噬发现该过程也可以在长时间饥饿条件下通过大宗自噬完成【4】。另外,在酵母系统里以前有报道发现核糖体自噬依赖于泛素蛋白酶体Ubp3p/Bre5p实现【5】,但是哺乳动物中还没有发现这样一个类似的机制。
在增殖的细胞中,核糖体在总蛋白和RNA量中占有很大的比重(~50%—~80%)。另外,核糖体似乎天生就是能量储存库,以为它其中蛋白质还富含精氨酸、RNA组分(分解出核糖苷),这些营养物可重新激活mTOR, 促进细胞生存。那么显而易见的是,David M. Sabatini组的这个工作给出了一个非常漂亮的解释。另外,这篇论文的思路也是非常清晰,数据扎实,非常值得学习。
其实,选择性自噬领域依然有很多未解的关键问题。
再讲几句题外话。这个工作本身很漂亮也很重要,笔者刚看这篇文章的时候就与第一时间与厦门大学林圣彩教授交流了一些看法,他认为“该工作发现了一种直接跟核糖体,同时也跟自噬体的LC3蛋白相互作用,最后把核糖体给吃掉。证据很漂亮”。好玩的是,今年5月6日-9日,EMBO组织了一次“溶酶体与代谢”的专题会议。

在会议第一天的首个session(Nutrient sensing and lysosomal signaling)中,Sabatini和林圣彩老师一前一后各有30分钟报告。据悉,他们在本次会议期间进行了友好的交流。

该会议中受邀做报告的除了林圣彩教授之外,还有贝勒医学院的王萌教授也做了30分钟邀请报告。
参考文献:
1、Khaminets, A., Behl, C., & Dikic, I. (2016). Ubiquitin-dependent and independent signals in selective autophagy. Trends in cell biology, 26(1), 6-16.
2、R. A. Saxton, D. M. Sabatini, mTOR Signaling in Growth, Metabolism, and Disease. Cell 168, 960–976 (2017). doi:10.1016/j.cell.2017.02.004pmid:28283069
3、M. Abu-Remaileh, G. A. Wyant, C. Kim, N. N. Laqtom, M. Abbasi, S. H. Chan, E. Freinkman, D. M. Sabatini, Lysosomal metabolomics reveals V-ATPase- and mTOR-dependent regulation of amino acid efflux from lysosomes. Science 358, 807–813 (2017). doi:10.1126/science.aan6298pmid:29074583
4、An, H., & Harper, J. W. (2018). Systematic analysis of ribophagy in human cells reveals bystander flux during selective autophagy. Nature cell biology, 20(2), 135.
5、Kraft, C., Deplazes, A., Sohrmann, M., & Peter, M. (2008). Mature ribosomes are selectively degraded upon starvation by an autophagy pathway requiring the Ubp3p/Bre5p ubiquitin protease. Nature cell biology, 10(5), 602.
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发