【1728】管中窥豹--从keynote-189和IMpower-150研究看PD-1/PD-L1 抗体治疗晚期实体瘤的未来
| 导读 | 作者:张晓实 中山大学附属肿瘤医院生物治疗中心来源:肿瘤资讯从2014年9月PD-1抗体帕博利珠单抗(Pembrolizumab)首次在美国... |
从2014年9月PD-1抗体帕博利珠单抗(Pembrolizumab)首次在美国上市以来,共有2种PD-1抗体和3种PD-L1抗体被FDA批准,获得的适应证包括皮肤黑色素瘤、头颈部鳞癌、无驱动基因突变的非小细胞肺癌、胃癌、肝癌、dMMR的实体瘤、肾癌、尿路上皮癌、典型霍奇金淋巴瘤、Merkel细胞癌等。长期随访结果证明PD-1抗体使晚期肿瘤患者长期生存。寻找机会接受PD-1/PD-L1抗体,争取更久的生存时间是广大患者的意愿。但是,临床应用PD-1/PD-L1抗体面临多重瓶颈,阻碍其广泛应用。
 张晓实教授
张晓实教授
PD-1/PD-L1抗体临床应用的瓶颈
缺乏公认的优势人群标志物
PD-1/PD-L1 抗体单药平均有效率为20%,但PD-1/PD-L1 抗体起效慢,中位起效时间12-16周,若不加选择地使用PD-1/PD-L1 抗体有可能贻误治疗。在筛选PD-1/PD-L1 抗体优势人群标志物中,肿瘤细胞PD-L1表达水平与PD-1/PD-L1抗体疗效的关系最受关注。PD-1/PD-L1抗体阻断PD-L1信号对T淋巴细胞的抑制作用,肿瘤细胞或肿瘤间质细胞表达PD-L1应该是预测药物敏感性的标志物。但是,多项临床研究并不支持这一观点,对其原因的解释莫衷一是。
已知PD-L1表达受干扰素γ和癌基因信号双重调节。一方面,癌基因信号调节PD-L1表达具有2个特点,一是PD-L1表达不代表机体免疫应答状态,二是癌基因信号阻碍PD-L1 mRNA降解,导致PD-L1蛋白持续表达,PD-L1对T淋巴细胞的抑制作用不易被PD-1/PD-L1抗体阻断。另一方面,T细胞释放的干扰素γ能否诱导肿瘤细胞表达PD-L1取决于肿瘤细胞的干扰素信号通路是否完整。Budczies分析TCGA数据库,观察到16%-21%肿瘤存在干扰素信号通路的突变。由于PD-1/PD-L1抗体促进T细胞浸润肿瘤组织,治疗后PD-L1阴性表达肿瘤可能转化成PD-L1阳性肿瘤。此外,PD-L1阳性的肿瘤可能合并其他免疫逃逸的机制。因此,治疗前PD-L1表达水平与PD-1/PD-L1抗体疗效的关系难以重复。
驱动基因突变肿瘤对PD-1抗体不敏感
多项临床研究观察到PD-1 抗体治疗EGFR突变或ALK重排NSCLC的有效率为5%-7%。如果EGFR或ALK抑制剂联合PD-1抗体,免疫相关肺炎发生率高。同样,尽管meta分析观察Nivolumab治疗BRAF V600突变型皮肤黑色素瘤的有效率与野生型患者无差别,但BRAF V600突变者的PFS明显短于野生型患者。
驱动基因突变肿瘤在多方面影响PD-1抗体疗效。驱动基因突变肿瘤的体细胞突变负荷较低,触发抗肿瘤免疫应答可能性小。加上PD-L1持续表达导致严重的免疫抑制微环境,进一步降低肿瘤对PD-1 抗体单药的敏感性。
转移灶部位制约PD-1抗体疗效
肝转移灶对PD-1抗体不敏感。PD-1抗体治疗黑色素瘤肺转移和淋巴结转移灶的有效率分别为59% 和38%,而肝转移灶的有效率波动于7%-29%之间。Tumeh观察到黑色素瘤和NSCLC肝转移是一种特殊的免疫亚型,T淋巴细胞不仅难以浸润肝转移灶,肝外转移灶也缺乏T淋巴细胞。
PD-1抗体诱导肿瘤超进展的风险
接受PD-1抗体治疗后小部分患者的肿瘤加速发展,称为超进展现象。例如,黑色素瘤和NSCLC的超进展发生率分别为9%和14%,头颈鳞癌的超进展发生率高达24%。目前对超进展现象的机制尚缺乏合理的解释,也有学者认为“超进展”是疾病本身发展所致,与PD-1抗体治疗无关。
上述瓶颈导致PD-1/PD-L1抗体临床应用的两极分化。一方面是铺天盖地的PD-1/PD-L1抗体治疗实体瘤的“突破性进展”,另一方面是临床医师感觉PD-1抗体犹如“六脉神剑”,时灵时不灵。从初步临床研究结果来看,我国肿瘤患者从PD-1/PD-L1抗体治疗中受益有限。例如,我国每年新发NSCLC患者73万人,但EGFR或ALK基因变异者约占一半。新发大肠癌患者38万人,85%以上是错配修复基因野生型的患者。另外,我国患者人数众多的乳腺癌、肝细胞、宫颈癌、脑胶质瘤等肿瘤对PD-1/PD-L1抗体单药不敏感。如何使更多实体瘤患者从PD-1/PD-L1抗体治疗中受益成为临床研究的主要任务。
如果PD-1/PD-L1抗体单药能否奏效只能“听天由命”,联合免疫治疗有可能“逆天改命”吗?2018年4月AACR年会报告的keynote-189和IMpower-150研究治疗非小细胞肺癌的临床研究结果,犹如暗夜中一道闪电,照亮了PD-1/PD-L1抗体治疗实体瘤的前景(表1)
表1 Keynote-189 和IMpower-150研究的特点
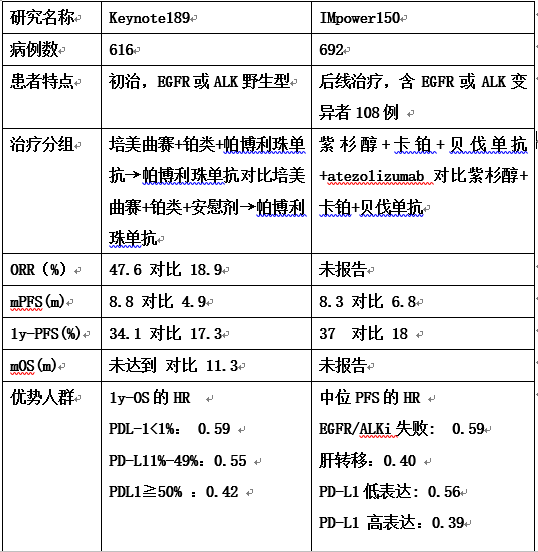
Keynote-189 和IMpower-150研究的启示
基线肿瘤细胞PD-L1表达水平不再是选择PD-1/PD-L1抗体的标志。
肿瘤细胞触发自发抗肿瘤免疫应答是PD-1抗体有效的前提。PD-1抗体促进淋巴细胞浸润肿瘤组织,浸润淋巴细胞释放干扰素γ,干扰素γ诱导PD-L1表达。因此,只要肿瘤免疫原性强,干扰素信号通路正常,治疗前肿瘤细胞是否表达PD-L1不是影响PD-1/PD-L1抗体有效性的关键因素。化疗、血管生成抑制剂和PD-1/PD-L1抗体均可能促进T细胞浸润肿瘤组织,因此,Keynote-189和IMpower-150的设计保障了肿瘤细胞表达PD-L1。
驱动基因突变不再是PD-1/PD-L1抗体治疗的障碍
与缺乏驱动基因突变的肿瘤相比,驱动基因突变肿瘤的突变负荷低,触发免疫应答的可能性小,PD-1 抗体单药有效率低下。但是,驱动基因突变诱导部分肿瘤细胞持续不断PD-L1。如果化疗和血管生成抑制剂进一步促进T淋巴细胞浸润(不一定是肿瘤抗原特异性T细胞),可保障绝大部分肿瘤表达PD-L1。尽管尚不清楚肿瘤细胞内PD-L1相关信号通路,但PD-L1抗体是IgG1型抗体,具有ADCC效应,可以直接杀伤肿瘤细胞或增加化疗敏感性。因此,IMpower-150 的设计使PD-L1成为一个稳定表达的靶点,将PD-L1 抗体Atezolizumab当作Her2抗体赫赛汀使用。同理,PD-L1抗体增敏化疗,打破肝转移灶的免疫抑制,IMpower-150的联合免疫治疗对肝转移灶有效。
联合治疗克服超进展风险
如果PD-1抗体导致肿瘤迅速增殖,反而提高化疗药物的敏感性。Keynote-189设计化疗联合PD-1抗体,解除PD-1抗体诱发超进展的风险。
如果上述3点启示在进一步的临床研究中得到证实,以PD-1/PD-L1抗体为基础的联合治疗将是实体瘤药物治疗的基本骨架(图1)。 在未来的临床实践中,临床医师可参考二代测序和生物信息学技术提供的肿瘤细胞的免疫原性(或抗原性)和干扰素信号完整性的评估报告,设计联合治疗方案。

PD-1抗体具有长效性。如果肿瘤的具备一定强度的免疫原性和可诱导PD-L1表达,设计以PD-1抗体为基础联合治疗较为合理。图1的诱导剂指能诱导肿瘤细胞免疫原性死亡和/或诱导PD-L1表达的药物和技术,包括细胞毒性化疗药物、小分子靶向药物、血管生成抑制剂、溶瘤病毒和放疗等。例如,贝伐珠单抗中和VEGF,具有多种免疫调节效应:1)调节树突细胞功能,促进抗原递呈。2)使肿瘤血管正常化,促进T细胞浸润肿瘤组织。3)抑制肿瘤微环境中不成熟的免疫抑制细胞,如MDSCs等。
如果肿瘤的免疫原性较低,但可能诱导PD-L1表达,设计以PD-L1抗体为基础的联合治疗较为合理。目前尚不清楚PD-L1抗体能否使患者长期生存。一旦PD-L1抗体的长效性得到证实,以PD-L1抗体为基础的联合免疫治疗可能形成“赢家通吃”的局面。如果PD-L1抗体的不具备长效性,还需要开发维持期的免疫治疗策略。
对于没有机会诱导PD-L1表达的患者而言(大约占20%),需要新型免疫治疗药物和技术来模拟免疫杀伤,清除肿瘤。
综上所述,Keynote-189 和IMpower-150研究的创新之处在于人为诱导PD-L1表达,使飘忽不定的PD-L1 成为一个固定的靶点。又基于肿瘤免疫原性,分别建立了以PD-1抗体和PD-L1抗体为基础的联合免疫治疗模型,为大多数实体瘤患者打开一道控制肿瘤和长期生存的希望之门。未来需要更多的临床研究来优化这两种联合免疫治疗策略,验证联合免疫治疗的高有效率能否转化为高生存率。
参考文献1.Budczies J, Bockmayr M, Klauschen F, et al. Mutation patterns in genes encoding interferon signaling and antigen presentation: A pan-cancer survey with implications for the use of immune checkpoint inhibitors. Genes Chromosomes Cancer. 2017;56(8):651-659.
2.Coelho MA, de Carné Trécesson S, Rana S, et al. Oncogenic RAS Signaling Promotes Tumor Immunoresistance by Stabilizing PD-L1 mRNA. Immunity. 2017; 47(6):1083-1099.e6.
3.Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer. N Engl J Med. 2018. doi: 10.1056/NEJMoa1801005.
4.Kowanetz M, Socinski M, Zou W, et al. IMpower-150: Efficacy of Atezolizumab Plus Bevacizumab and Chemotherapy in 1L Metastatic Nonsquamous NSCLC Across Key Subgroups. AACR 2018.
5.Ribas A, Hamid O, Daud A, et al. Association of Pembrolizumab With Tumor Response and Survival Among Patients With Advanced Melanoma. JAMA. 2016; 315(15):1600-9.
6.Tumeh PC, Hellmann MD, Hamid O, et al. Liver Metastasis and Treatment Outcome with Anti-PD-1 Monoclonal Antibody in Patients with Melanoma and NSCLC. Cancer Immunol Res. 2017;5(5):417-424.
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发