科学探讨!细胞周期对肿瘤免疫治疗的影响!
| 导读 | (点击进入)背景 尽管免疫检查点如PD-1和其配体PD-L1的靶点治疗已让肿瘤治疗获得长久的受益,当这类靶点治疗仍然对许多患者... |
2018中国微循环学会转化医学专业委员会成立大会暨第二届中国转化医学大会邀请函 (点击进入)


尽管免疫检查点如PD-1和其配体PD-L1的靶点治疗已让肿瘤治疗获得长久的受益,当这类靶点治疗仍然对许多患者不起作用,其中的机制并不明确。今天给大家带来一篇今年发表在Nature上的Letter,题目是《Cyclin D–CDK4 kinase destabilizes PD-L1 via cullin 3-SPOP to control cancer immune surveillance》,这篇文章就向我们阐明了其中可能的机制。
PD-L1的蛋白丰度在细胞周期进展中存在波动
已经报道过PD-L1的表达可被转录和翻译后修饰调节,但不明确是否在生理条件下如在细胞周期进展过程中PD-L1的稳定性会发生变化。于是作者用药物将细胞同步于细胞的不同周期检测PD-L1蛋白表达情况,发现在人类肿瘤细胞株中,PD-L1的丰度波动主要在M期和G1早期达到峰值,并在G1晚期和S期出现急剧下调(Fig. 1a-d)。
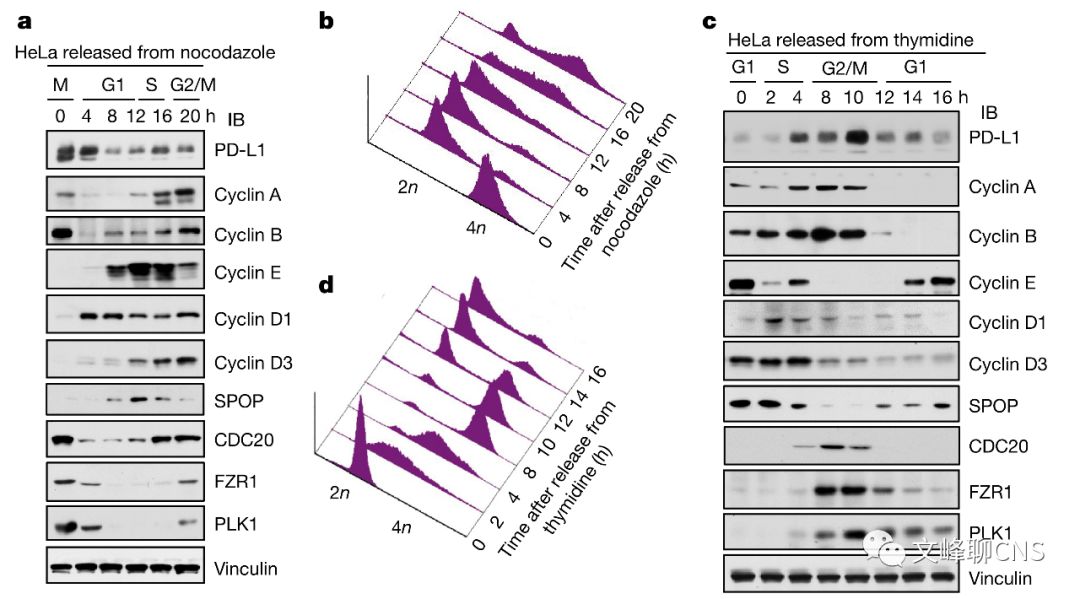
Cyclin D-CDK4负性调节PD-L1蛋白的稳定性
既然PD-L1的丰度波动与细胞周期相关,那么它的表达是否与细胞周期蛋白相关?因此,作者利用基因层面的方法在体内外都发现了细胞周期蛋白D(Cyclin D)的敲低或敲除相较于其他细胞周期蛋白更能上调PD-L1的表达(Fig. 2a-d)。
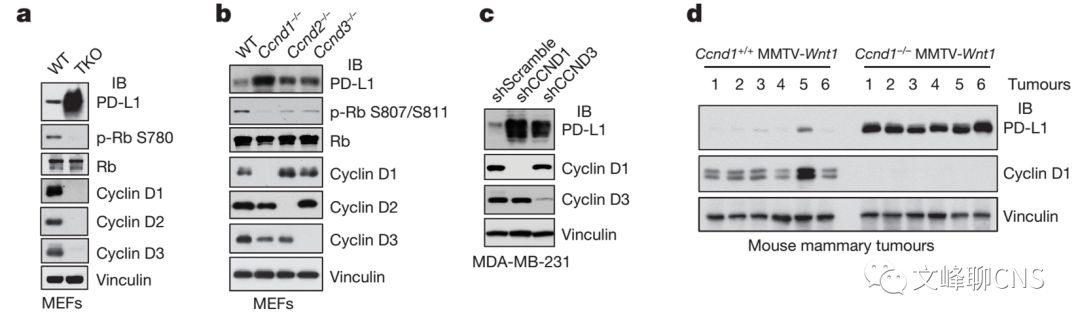
细胞周期蛋白依赖激酶(CDK)在细胞周期进展过程中调节细胞周期蛋白稳定性发挥了重要作用。作者同时发现Cyclin D相关激酶CDK4的 去除或药物的抑制也可以显著上调细胞中PD-L1的丰度(Fig. 2e-h)。同样,在体内实验也得到了验证。CDK4抑制剂的应用可以显著上调肿瘤模型中PD-L1的蛋白水平,并减少了CD3+的肿瘤浸润T细胞(TILs)的数量(Fig. 2i-k)。以上证实Cyclin D- CDK4在调节PD-L1水平上发挥了限速作用。
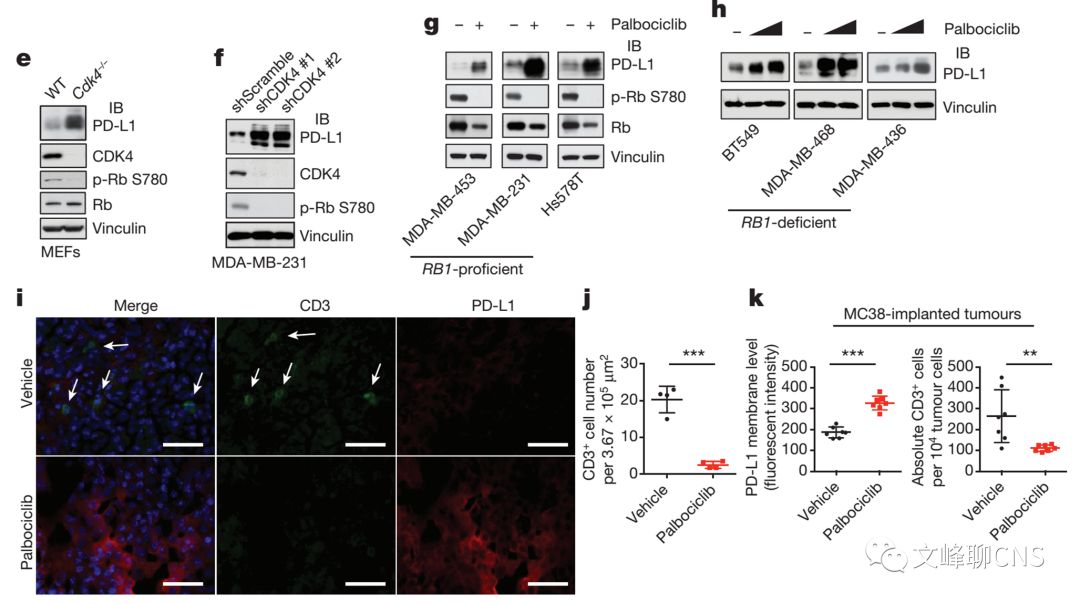
Cullin 3-SPOP是PD-L1的生理性E3泛素连接
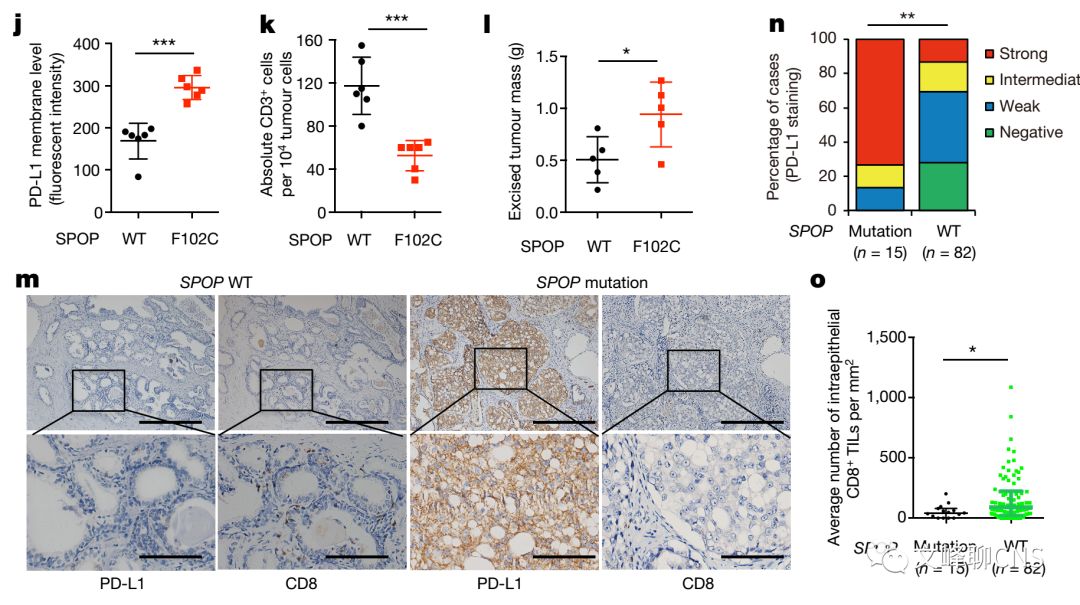
为了理解Cyclin D- CDK4是如何调节PD-L1水平的,作者首先证实用蛋白酶体抑制剂或culIin为基础的E3泛素连接酶抑制剂可提高PD-L1的蛋白水平(Fig. 3a)。为明确是cullin家族中哪种E3连接酶发挥作用,作者筛查了PD-L1与cullin家族中所有蛋白的相互作用,并发现cullin 3较其他cullin蛋白而言与PD-L1相互作用更显著(Fig. 3b)。Cullin 3相关的E3泛素化连接酶可通过底物募集衔接蛋白识别底物。于是作者发现相较于其他的衔接蛋白,SPOP与PD-L1存在蛋白互作(Fig. 3c、d)。并且敲除SPOP或其与底物相作用的结构域(MATH))都可增加细胞中PD-L1的表达(Fig. 3e、f)。SPOP在人类前列腺癌中可有10-15%的突变,且大部分都存在于MATH结构域。这些肿瘤来与的SPOP突变由于不能有效地结合PD-L1,致使不能促进PD-L1多聚泛素而被降解(Fig. 3g-i)。
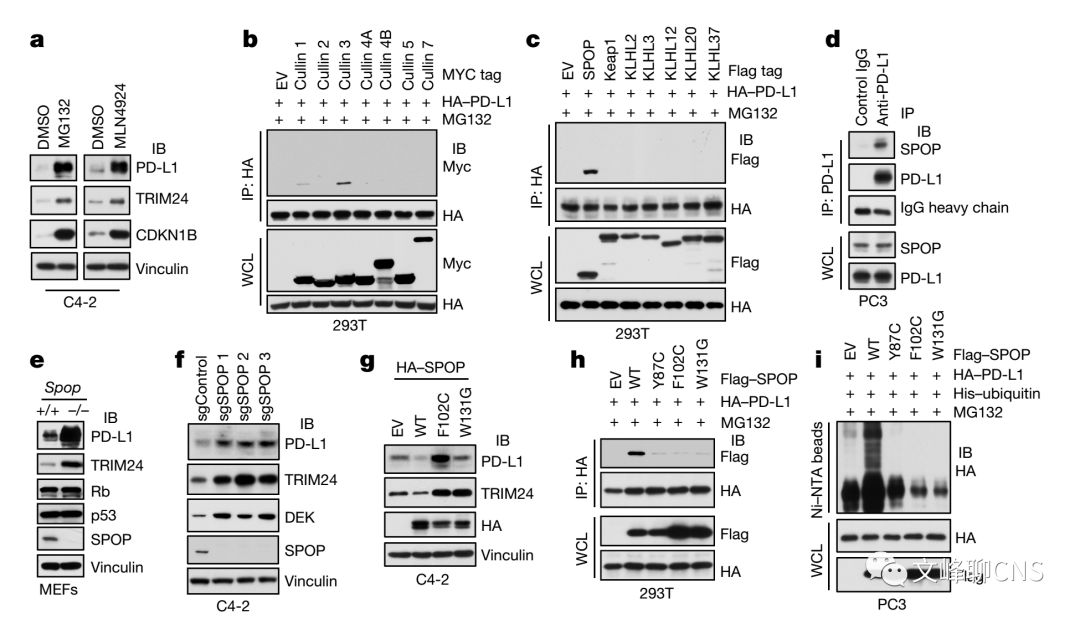
为证实SPOP突变在肿瘤形成中的作用,作者建立了表达野生型SPOP和突变型SPOP的肿瘤细胞株。他们发现表达突变型SPOP的细胞可显著提高内源性PD-L1(Fig. 3j)。利用这些细胞株建立肿瘤模型,可发现表达突变型SPOP的肿瘤增长显著快于野生型SPOP肿瘤(Fig. 3l)。利用临床标本(原发人类前列腺癌标本),作者同样证实了大部分SPOP突变的肿瘤中有很强的PD-L1的表达,并且其CD8+的TILs数量相较于SPOP野生型肿瘤明显减少(Fig. 3m-o)。
Cyclin D1-CDK4调节SPOP磷酸化通过14-3-3γ来破坏其与FZR1绑定稳定蛋白
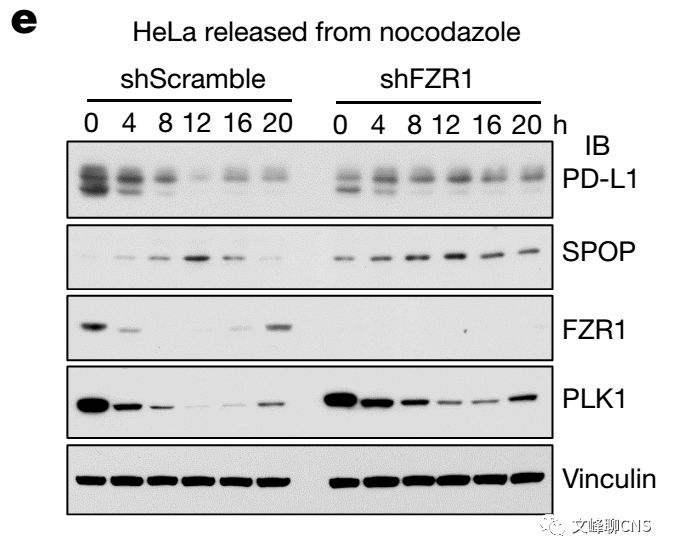
作者发现在细胞周期中SPOP蛋白的丰度也存在波动,与PD-L1蛋白水平存在负向相关,且在细胞周期中敲除SPOP也可引起PD-L1的上调(Fig. 4a)。同时,作者发现APC/C E3连接酶衔接蛋白FZR1(CDH1)在细胞周期中与SPOP蛋白水平存在负相关(Fig. 4a)。在细胞内,FZR1与SPOP存在蛋白互作。敲除SPOP上进化保守的结构域D-box可破坏FZR1与SPOP的连接,并抑制FZR1调节的SPOP多聚泛素致降解(Fig. 4b-d)。在细胞周期进展中敲除FZR1可使SPOP蛋白稳定不被降解,随后导致PD-L1蛋白水平的下调(Fig. 4e)。这些说明FZR1是一种在SPOP蛋白稳定性负性调节中很重要的上游E3连接酶。
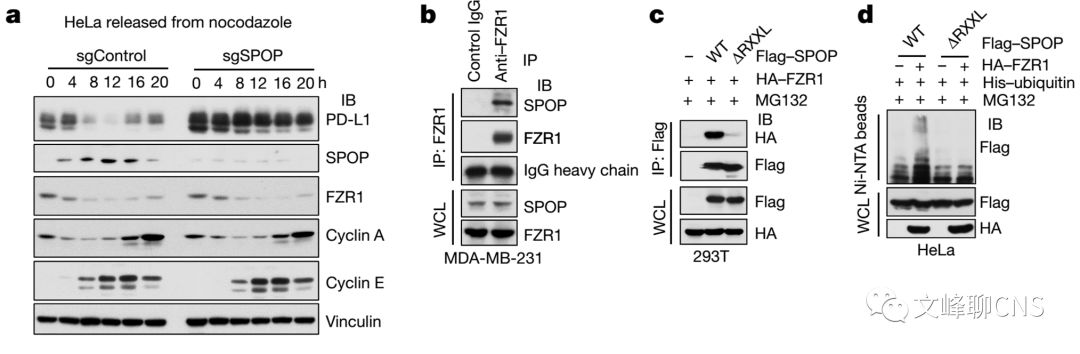
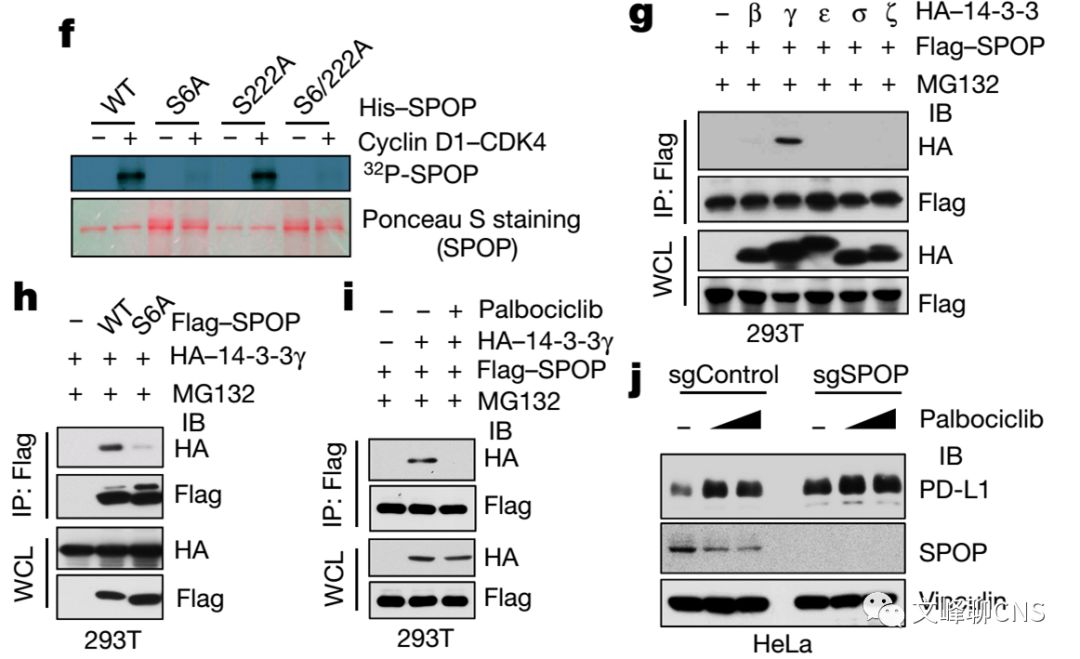
但是Cyclin D1-CDK4又是如何影响上述机制的呢?作者证实Cyclin D1-CDK4可直接磷酸化SPOP的Ser6位点(Fig. 4f)。并且14-3-3γ蛋白可与SPOP蛋白以磷酸化Ser6(p-Ser6)的方式作用,来破坏SPOP与FZR1的结合。抑制SPOP的p-Ser6可降低SPOP与14-3-3γ蛋白的作用,增加与FZR1的绑定(Fig. 4g-i)。在野生型SPOP的细胞中利用CDK4抑制剂可降低SPOP蛋白丰度,并上调PD-L1蛋白水平(Fig. 4j)。
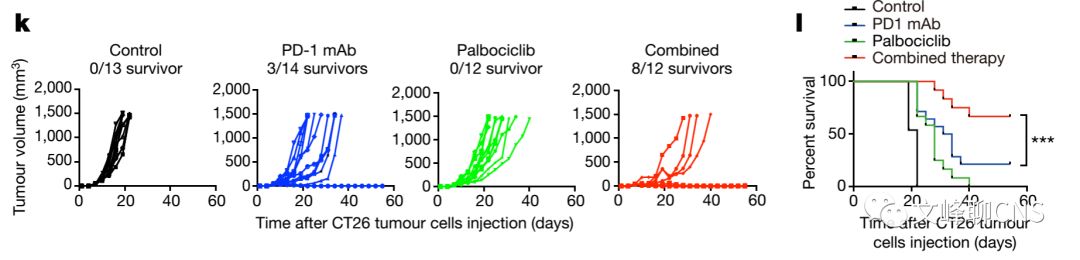
很多当前的临床研究已证实PD-1与PD-L1阻滞疗效的成功与肿瘤细胞PD-L1表达水平有密切的关系。而作者已经观察到DDK4抑制剂可增加PD-L1蛋白水平,故他们想证明是否CDK4抑制剂与PD-1-PD-L1抑制剂的联合治疗可调高其疗效。在动物模型中,作者确实观察到两者联合治疗可显著减缓肿瘤的进展,并提高动物的总生存(Fig. 4k、l)。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发