【国内药讯】 劝君慎谈“攻克”,艾滋病治疗依然任重道远(专业解读)
| 导读 | 实验结果显示,cART, BiIA-SG或者cART+BiIA-SG均不能够持续控制病毒滴度以及在人源化小鼠中控制HIV-1病毒感染,有趣的是,... |
4月23日,香港大学陈志伟组在著名期刊The Journal of Clinical Investigation上发表了题为 Tandem bispecific neutralizing antibody eliminates HIV-1 infection in humanized mice 的文章,描述了双特异性抗体在人源化小鼠实验中消除HIV-1感染的研究。

文章一经发表,立刻引起了国内媒体的广泛关注,甚至有媒体宣称“新药可清除艾滋病毒”。然而,真的是这样吗?这一研究的亮点究竟在哪里呢?
人类免疫缺陷病毒(Human immunodeficiency virus,简称HIV)是一种感染人类免疫系统细胞的慢病毒,属逆转录病毒的一种。目前学界普遍认为,人类免疫缺陷病毒的感染会导致艾滋病——一种后天性的、细胞免疫功能出现缺陷而导致严重随机感染及/或继发肿瘤并致命的疾病(Venkataramana Kandi et al., Cureus., 2016)。
HIV病毒分为两型:HIV-1与HIV-2。多数国家的HIV感染是由HIV-1造成的,并且感染HIV-1后超过90%的患者会在10到12年内发病成为艾滋病;HIV-2主要分布在西部非洲,其感染往往没有相关的病症。再考虑到致病性及传播范围等因素,科学家们主要把HIV-1亚型病毒作为主要研究对象。
|
亚型 |
致病性 |
感染性 |
传播范围 |
来源 |
|
HIV-1 |
高 |
高 |
全球 |
黑猩猩 |
|
HIV-2 |
较低 |
低 |
西非 |
乌白眉猴 |
两种HIV亚型的比较
HIV-1病毒是一种潜伏期极长的逆转录病毒,一旦感染,就很难彻底清除(Siliciano RF, et al., Curr Top Microbiol., 2017)。感染 HIV艾滋病本身并不是致命的,真正导致艾滋病患者死亡的,是患者在疾病晚期由于免疫力极度低下从而并发的各种机会性感染(Opportunistic infections,OIs)和肿瘤。截至2015 年底,我国共报告现存活 HIV感染者/AIDS 病人577,423 例,报告死亡182,882例,因艾滋病而死亡的病例数已连续多年位居国家法定传染病直报系统的首位,其中,各种OIs依然是我国 AIDS 患者就诊、入院、致死的主要原因。
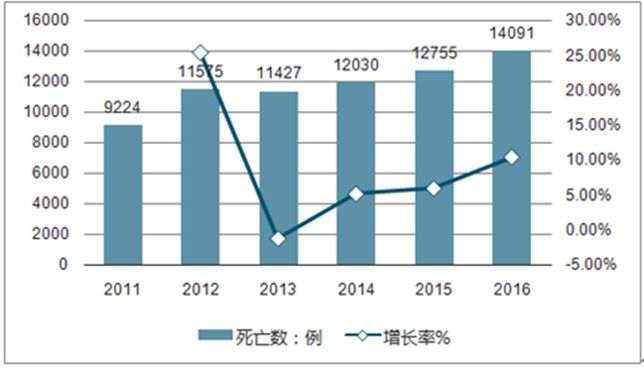
2011-2016年中国艾滋病死亡人数(资料来源:公开资料整理)
目前,艾滋病患者的主要治疗方法是大名鼎鼎的鸡尾酒疗法,它是由华裔科学家何大一教授提出的抗逆转录病毒治疗。该方法通过三种或三种以上的抗病毒药物联合使用来治疗艾滋病,可以减少单一用药产生的抗药性,最大限度地抑制病毒的复制,使被破坏的机体免疫功能部分甚至全部恢复,从而延缓病程进展,使其成为一种可控制的慢性疾病。
但是,部分HIV感染细胞在宿主体内是保持静止状态的,暂时不产生新的HIV病毒,因此药物无法对它们起作用。而这些所谓的潜伏性的病毒储存库却遍布全身,包括脑、骨髓和淋巴结等部位(Li TS, et al., Chin Med J., 2017),就犹如一个定时炸弹,随时都有可能引爆。所以,如何激活、如何清除病毒储存库就成了研究HIV病毒治疗的热门方向(Altfeld M, et al., Curr Opin HIV AIDS., 2016)。
鸡尾酒疗法
另一方面,HIV-1疫苗设计面临着巨大困难,主要是因为应用特异性的HIV免疫原来诱发机体产生针对HIV-1的广谱中和性抗体是比较困难的。最近许多HIV-1特异性的广谱中和性抗体的发现(Walker LM, et al., Science., 2009; Walker LM, et al.,Nature., 2011),已经证明了在病毒感染的自然过程中,机体会随着病毒共同进化,驱动B细胞成熟,并诱导产生有效的广谱中和性抗体,而这一类型抗体在体内体外实验中均表现出对机体的保护作用。这些发现表明,应用广谱中和性抗体被动治疗,应能给HIV-1患者带来希望。
回到本文开头提到的研究,文章述的是陈志伟课题组构建出一个双特异性抗体,并且在人源化小鼠身上能够起到保护作用,免除机体细胞被HIV-1病毒的感染。这一报道与2017年一个关于HIV疫苗的报道很相似,当时,强生公司的艾滋病疫苗I/IIa临床试验招募了393位健康志愿者,实验结果显示,志愿者对HIV疫苗耐受性良好,且100%产生了对抗HIV的抗体,但还没有足够证据能证明参与试验的志愿者在受病毒攻击时能得到有效的保护。

强生艾滋病疫苗相关报道
回到正轨,我们来看看这篇文章。陈志伟课题组是从以下四个方面展开实验研究的:

01
首先,研究小组挑选4个靶向HIV-1不同表位的抗体(PG16, PGT128, VRC01, Hu5A8)进行修饰表达,并把4个抗体进行联合使用,结果显示IA-PGT128 (gp120表位)和IA-Hu5A8(CD4表位)联用后有最强的中和效果。因此,研究人员选取这两个抗体来制备双特异性抗体BiIA-SG。在ELISA结合HIVCD4与gp120两个重组蛋白实验中,BilA-SG对两个重组蛋白均轻微减弱结合活性。
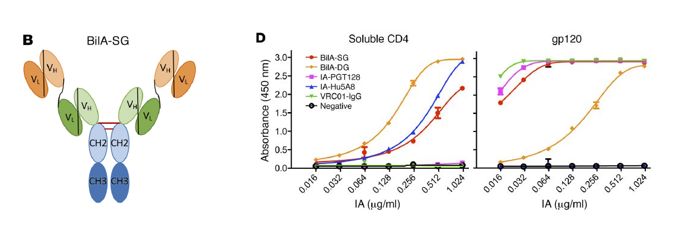
02
紧接着,研究小组通过假病毒中和实验来探究该双特异性抗体对 ①40株陈志伟实验室构建的HIV假病毒、②NIH实验室12株假病毒、③清华大学张林琦实验室72株假病毒的中和作用,结果显示,BilA-SG抗体相对于两个母系抗体有增强中和作用(平均IC50抑制浓度:0.073 μg/ml),而且有100%的广谱抑制活性。
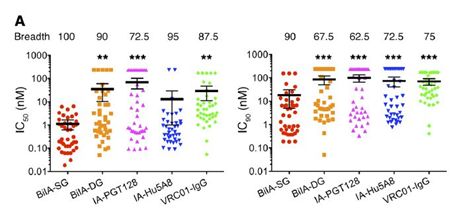
03
做完体外实验,研究小组开始检测该双特异性抗体在人源化小鼠(HIV-1/NSG-HuPBL模型)中的保护效果。在预防保护实验中,BiIA-SG实验组的5只小鼠的CD4+T细胞均没有被感染,并且在脾,肺,心脏等均检测不到P24+ T细胞。

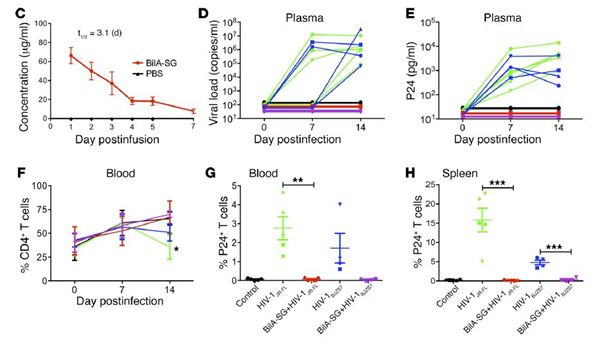
04
同时,研究小组也展开了小鼠保护实验来进一步探究特异性抗体的保护效果。实验结果显示,cART, BiIA-SG或者cART+BiIA-SG均不能够持续控制病毒滴度以及在人源化小鼠中控制HIV-1病毒感染,有趣的是,cART+BiIA-SG联用可以延缓病毒反弹时间。基于抗体不能够长时间维持住足够的抗体浓度,作者应用腺病毒(AAV)来表达BiIA-SG进行克隆治疗。结果显示单剂量的AAV-BiIA-SG治疗可以延缓反弹时间以及在人源化小鼠中消除感染的细胞。
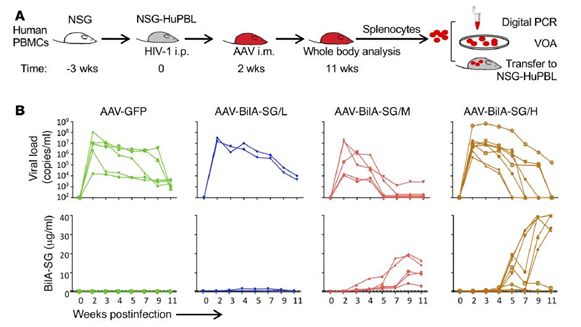
实验证实了使用中到高剂量的腺相关病毒载体(AAV)导入 BiIA-SG 可以让部分小鼠体内 HIV 病毒载量降低。但有效率并非 100%,中等剂量组的 5 只实验小鼠中有 4 只体内 HIV 病毒被抑制,高剂量组则是 8 只中有 5 只。从而证明了AAV-BiIA-SG具有很好的保护治疗作用。
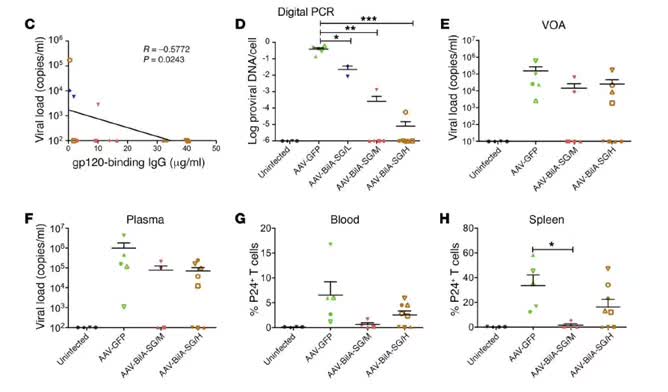
讲解完了这篇文章,我们可以通过思考和讨论,得出以下观点:
1 BiIA-SG不仅在体外能有效中和142株不同基因亚型的HIV,而且可以在预防保护实验中完全保护人源化小鼠免受多种HIV活病毒感染。
3 该研究涉及到在免疫缺陷的老鼠研究T细胞的感染实验,但人源化
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发