PD-L1抗癌效果不佳?罪犯蛋白-B7超家族被发现!
| 导读 | CD8 + T细胞在肿瘤微环境中“耗尽”的分子机制尚不清楚。程序性死亡配体-1(PD-1/PD-L1)在阻断人类肿瘤中具有显着效力。 |
导 读
CD8 + T细胞在肿瘤微环境中“耗尽”的分子机制尚不清楚。程序性死亡配体-1(PD-1/PD-L1)在阻断人类肿瘤中具有显着效力。然而,大多数患者对此并无反应,表明T细胞存在“耗尽的其他机制。 B7超家族成员1(B7S1)负调节T细胞活化。
研究人员在人类肝细胞癌的髓样细胞中发现上调表达的B7S1,这与CD8 + T细胞功能障碍相关。 联合阻断B7S1和PD-1增强了抗肿瘤免疫应答。B7S1引起CD8 + T细胞的功能障碍,其未来可用于癌症免疫治疗。
虽然肿瘤特异性CD8 + T细胞可以抑制肿瘤生长,但CD8 + T细胞常常在肿瘤微环境(TME)中发生功能失调或“耗尽”。然而阻断PD-1与其配体PD-L1的相互作用可重新激活用尽的CD8 + T细胞。
在肿瘤中也发现CD8 + T细胞的耗竭,并且肿瘤细胞上的PD-L1的过度表达足以抑制CD8 + T细胞的细胞毒性(Juneja等,2017)。 PD-1/PD-L1通路阻断可使肿瘤中的CD8 + T细胞恢复活力并已被批准用于治疗多种癌症。
在许多其他类型的癌症中,只有一小部分人群(约30%)对抗PD-1或抗PD-L1治疗有反应,而无反应者经历短暂的受损T细胞的再激活,然后则发生复发,这提示存在驱动T细胞耗竭的其他机制。 B7家族成员之一B7S1在2003年被发现。
由于B7S1的表达在多个实体瘤中被发现,并且与患者预后和肿瘤中T细胞的浸润呈负相关,因此B7S1可作为癌症免疫疗法中有希望的靶点,用以重新激活抗肿瘤T细胞功能。然而,B7S1在肿瘤免疫中的功能意义和分子机制尚不明确。
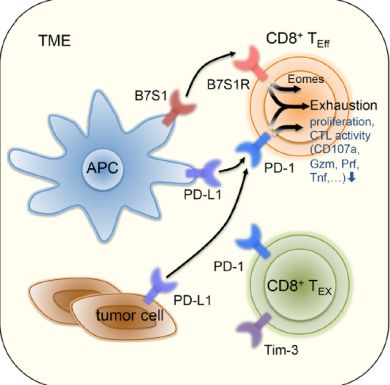
B7S1与PD-L1与T细胞耗尽
该研究的研究结果表明肿瘤浸润性APC表达B7S1并通过上调Eomes驱动T细胞功能障碍和CD8 + T细胞的耗竭。 B7S1可能与PD-1联合靶向可以进一步逆转T细胞耗竭并使癌症免疫治疗获益。同时研究发现B7S1阻断的功效可能适用于所有阶段的肿瘤。
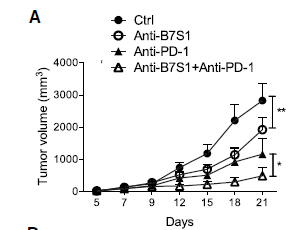 、
、
联合阻断B7S1和PD-1能够有效减缓肿瘤进展
PD-1和B7S1阻断的组合在E.G7和Hepa1-6模型中显示出很强的抗肿瘤协同作用。与通过不同分子机制诱导抗肿瘤应答不同(,抗PD-1和抗B7S1似乎通过许多的共享途径作用于同一细胞,这提示这种机制是免疫检查点联合阻断协同作用的基础。

B7S1R和PD-1在CD8 + TIL上的共表达以及它们在很大程度上重叠的下游信号通路可能允许抑制具有不同空间和时间分布的这两种分子配体诱导的T细胞。
此外,当两条通路都打开时,来自每个通路的抑制性信号可协调工作并产生“1 + 1> 2”效应,进一步驱动CD8 + TILs的功能障碍和耗尽。因此,可以明确T细胞耗竭通过多种共抑制途径来实现,并且靶向B7S1-B7S1R共抑制途径可能会增强当前抗PD-1疗法对于癌症尤其是HCC的疗效。
参考文献:
Jing Li, Younghee Lee, Yanjian Li, Tak W. Mak, Ling Ni. Co-inhibitory Molecule B7 Superfamily Member 1 Expressed by Tumor-Infiltrating Myeloid Cells Induces Dysfunction of Anti-tumor CD8+ T Cells
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发