Dev Cell | 杨辉组报道新型高效精确的基因靶向整合策略,或将极大促进人类胚胎发育以及疾病突变修复研究
| 导读 | 责编丨迦 溆CRISPR / Cas9介导的新型DNA编辑工具为构建小鼠动物模型以及疾病突变的靶向修复提供了巨大的潜力.然而,通过传统... |
CRISPR / Cas9介导的新型DNA编辑工具为构建小鼠动物模型以及疾病突变的靶向修复提供了巨大的潜力。然而,通过传统的同源重组(HR)方式进行靶向整合的效率一般比较低【1】,极大地限制了CRISPR/Cas9技术的应用。杨辉博士自回国在中科院神经所建立实验室以来,主要从事CRISPR/Cas9基因编辑技术的开发优化以及应用,最近几年发表了多项重要的工作,详见BioArt此前的报道(杨辉、黄鹏羽合作组利用dCas9转基因小鼠在脑内实现多基因同时激活;杨辉组利用CRISPR技术获得基因敲入猴;杨辉组借助CRISPR/Cas9敲除一整条染色体)。
据了解,杨辉实验室建立初期,由于CRISPR领域竞争力强大以及实验平台不完善,研究成果多次被国内外同行抢发。2016年11月,美国Salk研究所的Belmonte团队利用同源非依赖性靶向插入(homology-independent targeted integration,HITI,NHEJ的优化版本)的策略,首次将新基因插入到不再分裂的成熟细胞的精准DNA位置,并成功地修复色素性视网膜炎大鼠的视网膜细胞【2】。与此同时,杨辉实验室研究人员优化PITCh(precise-integration-into-target-chromosome)系统,即使用依赖于微同源介导的末端接合(microhomology-mediated end-joining,MMEJ)的策略,可以有效地修正Fah基因突变继而挽救Fah-/-肝衰竭小鼠,为精确靶向基因治疗提供了一种新的方案(与上科大黄鹏羽团队合作完成)【3】。之后,杨辉实验室研究人员进一步优化供体载体,并建立了一种新的以同源臂介导的末端接合(homology-mediated end-joining,HMEJ)为基础的靶向精确整合策略,即利用带有单个向导RNA(sgRNA)靶向位点和长同源臂(约800bp)的供体载体在很多种系统(包括培养中的细胞、动物胚胎和体内组织)中实现高效的精确整合(与神经所施霖宇团队、孙强团队合作完成)【4】,并以此技术首次报道获得基因敲入猴【5】。
不难发现以上所有系统都依赖于CRISPR / Cas9在体内对供体载体进行有效地切割,那么如果在体外完成供体载体的切割,是否可以提高靶向整合的效率呢?
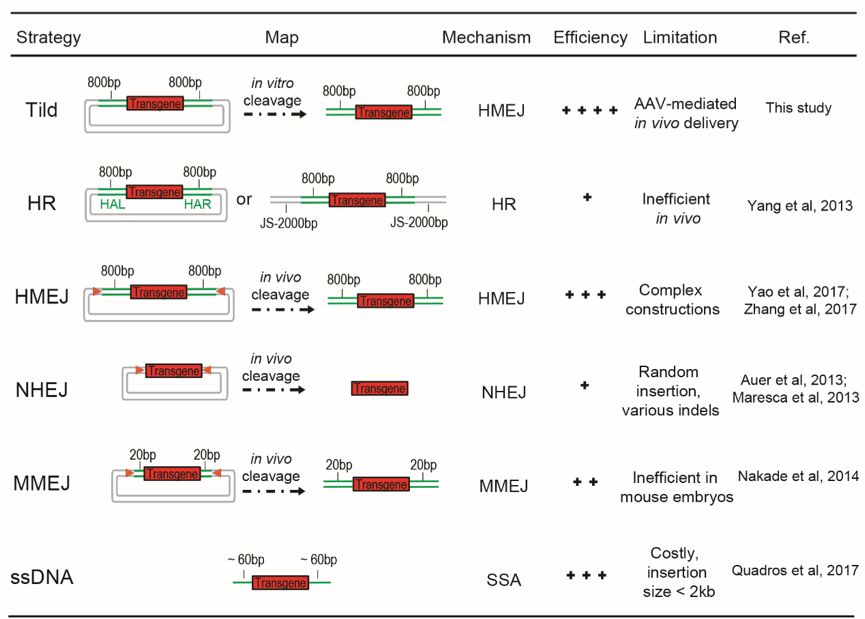
不同转基因靶向整合策略的比较
5月21日,Developmental Cell期刊在线刊登了题为Tild-CRISPR Allows for Efficient and Precise Gene Knockin in Mouse and Human Cells的研究论文,该研究由中科院神经科学研究所、脑科学与智能技术卓越创新中心杨辉研究组与山东大学附属生殖医院、上海交通大学医学院附属仁济医院陈子江教授课题组合作完成。

在最新发表的这项工作中,研究团队基于CRISPR/Cas9系统,设计了一种新的靶向整合策略Tild-CRISPR (Targeted Integration with Linearized dsDNA-CRISPR),通过PCR扩增或者精确酶切获得含有800bp同源臂的转基因供体与Cas9 mRNA以及single-guide RNA一起注射到小鼠受精卵中。相比现有的靶向策略,该方法在注射的小鼠胚胎中表现出最高的敲入效率,并成功地在6个不同的位点分别获得了从0.8 kb到6.0 kb 不同长度外源基因的敲入小鼠。同时,与HR或HMEJ介导的方法相比,Tild-CRISPR在子宫内电转实验中显示了更强大的体内DNA 敲入能力(下图)。
至今为止,科学家们已经鉴定了超过10000种单基因遗传疾病,全球有数百万人深受其害。目前科学家们也着手在人类胚胎中利用基因编辑技术研究早期胚胎发育和遗传疾病。但是在已有策略中,人胚胎的基因编辑效率都比较低【6,7】。因此,杨辉团队与山东大学附属生殖医院、上海交通大学医学院附属仁济医院陈子江教授课题组合作,将Tild-CRISPR导入医疗废弃的3PN人胚胎,结果惊奇地发现,Tild-CRISPR方法介导的基因敲入效率比传统的HR介导的方法高12倍,这极大地促进了研究人类胚胎发育以及修复疾病突变。
综上所述,该研究设计了一种新型基因靶向整合策略Tild-CRISPR,它可以在小鼠和人的细胞中实现高效精确的基因敲入。Tild-CRISPR不仅适用于高效地构建小鼠动物模型,同时为研究体内的基因功能以及开发潜在的基因疗法提供新思路。就在去年,来自俄勒冈健康与科学大学的Mitalipov研究团队利用CRISPR-Cas9技术,精确地靶向MYBPC3突变,激活内源性的生殖细胞特异性DNA修复反应,用来修复植入前人类胚胎中的杂合MYBPC3突变【8】(【黄军就点评】科学狂人Nature发表编辑人类胚胎成果)。相信随着研究的不断深入,CRISPR/Cas9技术会在不久的将来在体内实现精确并且高效的基因编辑,为临床基因治疗提供无限可能。
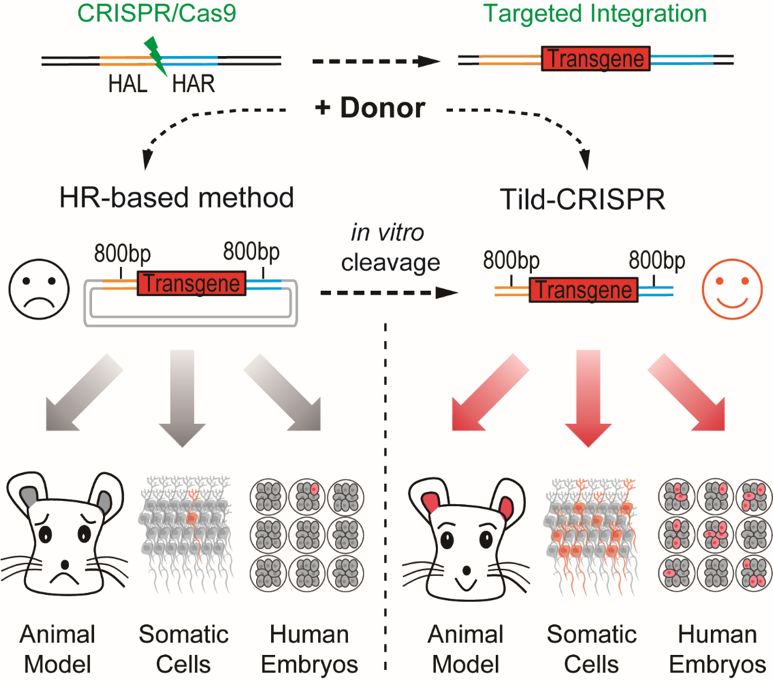
研究模式图:Tild-CRISPR,通过体外PCR扩增或者精确酶切获得含有800bp同源臂的线性转基因供体,可以在小鼠胚胎,小鼠大脑以及人胚胎中实现高效的DNA靶向整合。
据悉,该项工作由神经所助理研究员姚璇博士、博士研究生王兴与仁济医院章美玲博士在神经所灵长类疾病模型研究组杨辉研究员与山东大学附属生殖医院、上海交通大学医学院附属仁济医院陈子江教授的指导下完成。
附杨辉课题组招聘启事:
中科院神经所杨辉组致力于CRISPR各种相关工具的开发及应用,以及推动基因治疗的临床转化。现招聘博士后及副研究。
博士后要求及待遇:至少发表一篇专业领域期刊文章, 如Journal of biological chemistry, Journal of neuroscience, Biology of reproduction, Molecular therapy, Molecular plant等,待遇20-30万/年。
副研究员要求及待遇:有出国留学经历及良好的英文写作能力,至少发表一篇PNAS或以上文章,待遇20-40万/年。
联系邮箱:huiyang@ion.ac.cn
实验室网址:
http://www.ion.ac.cn/laboratories/int.asp?id=98
参考文献
1. Taylor, R.C., Cullen, S.P., and Martin, S.J. (2008). Apoptosis: controlled demolition at the cellula level. Nat. Rev. Mol. Cell Biol. 9, 2
2. Suzuki K, Tsunekawa Y, Hernandez-Benitez R, Wu J, Zhu J, Kim EJ, Hatanaka F, Yamamoto M, Araoka T, Li Z, et al: In vivo genome editing via CRISPR/Cas9 mediated homology-independent targeted integration. Nature 2016, 540:144-149.
3. Yao X, Wang X, Liu JL, Hu XD, Shi LY, Shen XW, Ying WQ, Sun XY, Wang X, Huang PY, Yang H: CRISPR/Cas9 - Mediated Precise Targeted Integration In Vivo Using a Double Cut Donor with Short Homology Arms. Ebiomedicine 2017, 20:19-26.
4. Yao X, Wang X, Hu XD, Liu Z, Liu JL, Zhou HB, Shen XW, Wei Y, Huang ZJ, Ying WQ, et al: Homology-mediated end joining-based targeted integration using CRISPR/Cas9. Cell Research 2017, 27:801-814.
5. Yao X, Liu Z, Wang X, Wang Y, Nie YH, Lai L, Sun R, Shi L, Sun Q, Yang H: Generation of knock-in cynomolgus monkey via CRISPR/Cas9 editing. Cell Res 2018, 28:379-382.
6. Kang XJ, He WY, Huang YL, Yu Q, Chen YY, Gao XC, Sun XF, Fan Y: Introducing precise genetic modifications into human 3PN embryos by CRISPR/Cas-mediated genome editing. Journal of Assisted Reproduction and Genetics 2016, 33:581-588.
7. Tang LC, Zeng YT, Du HZ, Gong MM, Peng J, Zhang BX, Lei M, Zhao F, Wang WH, Li XW, Liu JQ: CRISPR/Cas9-mediated gene editing in human zygotes using Cas9 protein. Molecular Genetics and Genomics 2017, 292:525-533.
8. Ma H, Marti-Gutierrez N, Park SW, Wu J, Lee Y, Suzuki K, Koski A, Ji DM, Hayama T, Ahmed R, et al: Correction of a pathogenic gene mutation in human embryos. Nature 2017, 548:413-+.
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发