重大成果 | Nanopore测序精准鉴定基因组结构变异,让全外显子组检测阴性案例得到确诊,为PGD提供重要参考
| 导读 | 中南大学生殖与干细胞工程研究所张前军研究员与希望组首席科学家王凯教授等带领的团队采用Nanopore测序技术,在一例全外显子组检测阴性的患儿中精准鉴定出基因组结构变异,对患儿进行了确诊,明确了结构变异的来源,帮助夫妇成功生育一名健康宝宝。 |

导 读
中南大学生殖与干细胞工程研究所、中信湘雅生殖与遗传专科医院的张前军研究员与希望组首席科学家王凯教授等带领的团队采用Nanopore测序技术,在一例全外显子组检测阴性的患儿中精准鉴定出基因组结构变异,不仅对患儿进行了确诊,同时还明确了结构变异的来源,从而为胚胎植入前遗传学诊断提供了重要参考,帮助夫妇成功生育一名健康宝宝。该研究于2018年5月21日在线发表在BioRxiv上。
2018年5月21日,BioRxiv在线发表了一篇题为《Long-read sequencing identified a causal structural variant in an exome-negative case and enabled preimplantation genetic diagnosis》的研究成果,本研究由中南大学生殖与干细胞工程研究所、中信湘雅生殖与遗传专科医院的张前军研究员与希望组首席科学家王凯教授等带领的团队合作完成。研究采用Nanopore测序技术在一例全外显子组检测(Whole Exome Sequencing,WES)阴性的患者中精准鉴定出基因组结构变异(Structural Variations,SVs),不仅对患者进行了确诊,同时还明确了结构变异的来源,从而为胚胎植入前遗传学诊断(Preimplantation Genetic Giagnosis,PGD)提供了重要参考,帮助夫妇成功生育一名健康宝宝。
研究背景
近年来WES已成为孟德尔遗传病的主流临床研究或检测方法,然而,由于二代测序技术的读长较短,WES的大部分检测结果(约60-70%)为阴性。即使基于二代测序的全基因组测序(Whole Genome Sequencing, WGS)似乎也不能显著提高诊断率,且性价比不高。因此,WES / WGS阴性病例已成为目前遗传病临床研究或诊断的巨大挑战,其中最主要的原因是,基于二代测序技术的WES和WGS对结构变异等复杂区域的检测常常无能为力。
长读长测序技术(也称为第三代测序技术),如Oxford Nanopore和 PacBio SMRT测序技术,凭借超长读长、极低GC偏好性、直接检测甲基化等优势,突破二代测序技术瓶颈,弥补了基于短读长测序的WES / WGS的不足,可精确检测结构变异、串联重复序列等,从而提高更多疾病的诊断率。
研究内容
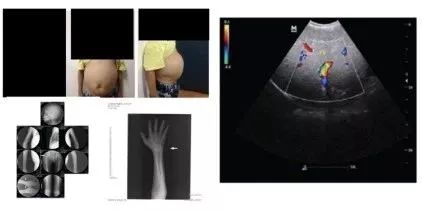
2017年,12岁男童因肝脾肿大和生长迟缓随父母到中信湘雅生殖与遗传专科医院就诊。父母期望患儿能得到确诊,并希望通过第三代试管婴儿技术孕育健康后代。
娃娃脸(Doll-like facies,HP:0000295)
腹部隆凸(Protuberant abdomen,HP:0001538)
肝脾肿大(Hepatosplenomegaly,HP:0001433)
臀部和手腕表现为骨质疏松(Osteoporosis,HP:0000939)
空腹血糖值为0.17 mmol/l,达到危险的低值。胆固醇、甘油三酯和氯的水平不正常。肝脏功能检查结果显示,转氨酶升高(AST/ALT)和其他生化异常。血清铜和铜蓝蛋白含量正常。
通过临床表型及生化检查,初步判断该患儿可能患有糖原累积病Ia型(GSD-Ia)。
为验证临床上的初步判断,首先对患者进行全外显子组测序,结果显示,患者的G6PC基因上存在一个纯合错义突变(c.326G>A),该位点在蛋白序列中高度保守(Fig.1)。根据OMIM记载(Fig.2):染色体17q21上编码葡萄糖-6-磷酸酶的G6PC基因上的纯合或复合杂合突变可能引起GSD-Ia,遗传模式为常染色体隐性遗传(AR)。结合生物信息分析软件InterVar的预测结果,按照ACMG 2015版指南将该变异定级为likely pathogenic。

Fig.1 G6PC基因编码的蛋白质序列在该位点为高度保守区域

Fig.2 OMIM对G6PC基因的介绍
结合家族史问询,推测患者的父母皆为G6PC基因位点变异携带者,患者为纯合变异,谱系图如下(Fig.3):
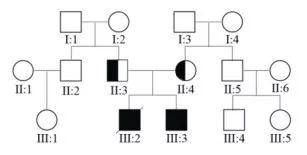
Fig.3 结合家族史问询和疾病AR遗传模式的谱系图
一切都在按部就班的进行,只要最后一步Sanger验证结果符合该变异的遗传模式,一份阳性报告就可以成文了。
然而,一代验证结果(Fig.4)却与推测不符:只有母亲携带该位点的杂合变异,父亲未携带变异。那全外显子组检测到的患者的纯合变异从何而来?
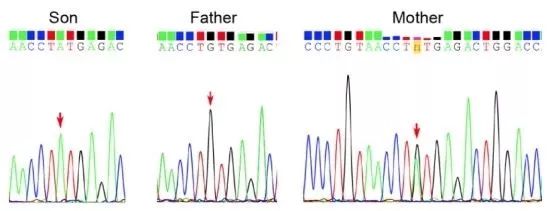
Fig.4 患者及其父母的Sanger验证结果
难道是由于父亲存在生殖细胞嵌合现象?
于是又对父亲的血液和精子DNA进行了Sanger测序验证,然而测序结果并没有给出确定的答案:在父亲精子DNA的c.326位点出现了一个小的A等位基因峰和一个更小的C等位基因峰(Fig.5 右)。这???
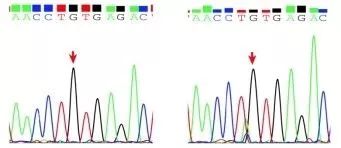
Fig.5 患者之父 血液(左)和精子(右)DNA 的Sanger验证结果
在该案例中,WES无法解释致病变异和遗传模式的冲突、无法确定变异来源、无法精确诊断致病变异。于是研究人员采用最新的Nanopore长读长测序技术,对患者进行全基因组检测,在~12×的低测序深度下,在患者G6PC基因的一个等位基因上检测到长达7Kb的缺失突变:chr17 g.41049904_41057049del7146 (GRCh37),有4条Nanopore reads能对该缺失突变进行支持(Fig.6)。通过定量RT-PCR和Sanger测序也很好地验证了这段缺失变异(Fig.7)。

Fig.6 4条Nanopore reads显示的缺失区域
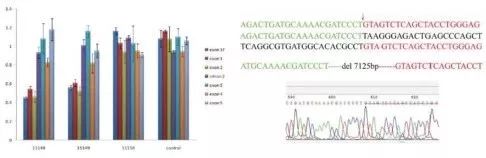
Fig.7 定量RT-PCR和Sanger测序验证结果
该缺失变异覆盖了G6PC基因的5’调节区域、外显子1、内含子1、外显子2、内含子2的一部分,共计7125 bp,最终导致了基因功能丧失(loss of function)。
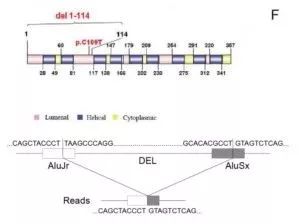
该患者携带来自母亲的错义突变(c.326G>A)和来自父亲的缺失变异(chr17 g.41049879_41057003del7125),最终导致疾病的发生。
为了能够生育一个健康的孩子,该家庭选择了进行试管婴儿。当四个胚胎发育到囊胚期时,对胚胎进行植入前遗传学诊断(PGD),并根据之前明确的错义突变(c.326G>A) 和缺失变异(chr17 g.41049879 _41057003del7125),通过PCR判断出四个胚胎均没有缺失变异,但是四个胚胎均为错义突变的携带者。最后,通过综合考虑,将最安全的胚胎植入到母体内。
母亲孕19周时,采集羊水进行基因检测,检测结果证实了胎儿是错义突变的携带者
(c.326G> A),但没有遗传父亲的缺失变异(chr17 g.41049879_41057003del7125)。新生儿出生后亦进行血糖、肝脏、脾脏等检测,结果显示不表现为GSD-Ia。
研究结论
基于二代测序的WES/WGS的阴性报告,一直是临床研究的重点和难点。本文开拓性的应用Nanopore长读长测序技术,突破二代测序检测基因结构变异的技术瓶颈,不仅使患儿得到确诊,也为患者父母再次生育进行PGD时提供了重要参考,从而助力孕育更健康的宝宝。
希望组

作为全球最大三代测序应用公司、全球最大的Oxford Nanopore测序中心,致力于研发和推广长读长测序技术在医学中的应用,目前已重磅推出“华夏万人SV”,旨在构建中国健康人群高分辨基因组结构变异图谱、单碱基精确度的DNA甲基化图谱,弥补目前基因组数据库的空白,进而通过对大规模的疾病群体进行基因组结构变异分析,明确广泛的疾病和病症相关的罕见遗传变异,这将对中国人群基因组学研究、遗传性疾病研究、精准医疗应用等领域产生重要的科学及临床价值。
参考文献
Hefan Miao, Jiapeng Zhou, Qi Yang, et al. Long-read sequencing identified a causal structural variant in an exome-negative case and enabled preimplantation genetic diagnosis. bioRxiv preprint first posted online May. 21, 2018.
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发