CRISPR超级大牛David Liu继续创造辉煌,首次在体内的非分裂细胞进行基因编辑,该技术可能拯救数千万患者
| 导读 | cytidine and adenine base editors by expression optimization and ancestral reconstruction近年内兴起的CRISPR/Cas9基因编辑技术利... |
iNature
2018年6月5日,David Liu研究组在Nature Communications在线发表题为“In vivo base editing of post-mitotic sensory cells”的研究论文,该论文揭示了通过局部注射碱基编辑器RNP:脂质复合物进入小鼠内耳,建立了有丝分裂后感觉细胞的体内碱基编辑。这种方法具有体内细胞重编程的潜力,原则上可应用于当前治疗重复给药的其他疾病,其市场份额达到数千万,甚至上亿,如果能应用到临床,将会颠覆整个制药领域。另外,如果结合5月29日David Liu改进的BE4碱基编辑器,会极大的推动CRISPR技术在临床上的应用。2018年5月29日,David Liu在Nature Biotechnology杂志发表题为“Improving cytidine and adenine base editors by expression optimization and ancestral reconstruction”的研究论文,该论文显示表达水平是碱基编辑效率的一个瓶颈。 通过修饰核定位信号(NLS)和密码子使用以及脱氨酶组分的重构来优化胞苷(BE4)和腺嘌呤(ABE7.10)碱基编辑,由此产生的BE4max,AncBE4max和ABEmax编辑器可以在各种哺乳动物细胞类型中纠正致病性SNP,并大大提高效率。另外,2018年3月1日,David Liu 研究组在Nature发表题为“Evolved Cas9 variants with broad PAM compatibility and high DNA specificity”,该论文发现经过改造后的Cas9蛋白可以在基因组中的更多位点上起作用,并且具有更少的脱靶的影响。这些发现扩大了CRISPR系统的DNA靶向范围,并确定在Cas9编辑效率,PAM兼容性和DNA特异性的关系;2018年2月16日,David Liu 研究组在Science发表题为“Rewritable multi-event analog recording in bacterial and mammalian cells”,该文章在细菌和人类细胞中都显示了这种CRISPR技术如何记录光照,抗生素和病毒感染或记录内部分子事件,这项研究突出了人们利用CRISPR中的发现创造这些合成途径的真正创新方式。现在iNature进行系统的解读,希望对你有用。
1.In vivo base editing of post-mitotic sensory cells

Wnt激活诱导细胞质中β-连环蛋白的积聚并转移到细胞核中,导致Wnt靶基因的活化。 在缺乏Wnt激活的情况下,胞质β-连环蛋白在特定的丝氨酸和苏氨酸残基处被糖原合成酶激酶3β(GSK-3β)磷酸化。 磷酸化的β-连环蛋白被含有β-转导蛋白重复序列的蛋白(β-TrCP)所识别,导致β-连环蛋白的泛素化和降解。 以前使用小分子GSK-3β抑制剂和组蛋白去乙酰酶抑制剂来上调Wnt应答基因,导致支持细胞的大量扩增和体外分化成毛细胞。 然而,抑制与GSK-3β具有同源性的蛋白激酶引起的毒性以及广泛上调Wnt活性的潜在致癌作用限制了小分子GSK-3β抑制剂在体内的应用。
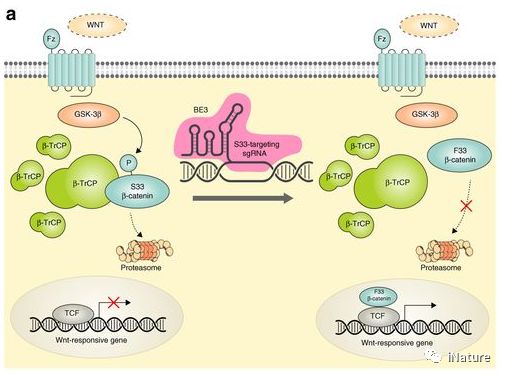
Wnt信号
可编程的核酸酶可以通过同源性定向修复(HDR)引入对基因组DNA的精确改变。不幸的是,HDR很大程度上局限于有丝分裂细胞,并且通常伴随有过量的随机插入和缺失(indel)。
在这里David Liu等研究组提出一个解决这些限制的体内碱基编辑策略。David Liu等研究组使用无核酸酶的碱基编辑在β-连环蛋白中引入S33F突变,其阻断β-连环蛋白磷酸化,阻止β-连环蛋白降解并上调Wnt信号传导。在体外,碱基编辑器引入了S33F突变。在小鼠内耳的有丝分裂后细胞中,碱基编辑蛋白质:RNA:脂质的注射可以引入该突变,导致Wnt活化,其诱导耳蜗支持细胞的有丝分裂和细胞重编程。相反,注射HDR剂不会诱导Wnt上调。这些结果建立了修改信号途径中翻译后状态的策略,以及在有丝分裂后组织中进行精确编辑的方法。
尽管在耳蜗中激活Wnt通路可能不足以恢复受损耳蜗的功能,但这些发现表明通过精确的体内编辑策略操纵复杂信号通路的可能性。 这种方法具有体内细胞重编程的潜力,原则上可应用于当前治疗重复给药的其他疾病。
原文链接:
https://www.nature.com/articles/s41467-018-04580-3
2.Improving cytidine and adenine base editors by expression optimization and ancestral reconstruction

近年內兴起的CRISPR/Cas9基因编辑技术利用可设计的Cas9核酸酶通过碱基插入、缺失或替换等方式,对生物体基因组DNA特定片段进行改造,进而实现对靶基因的编辑。传统的CRISPR/Cas9基因编辑技术虽然具有较高的基因敲除效率,但其在执行碱基替换(对譬如基因突变进行矫正)的效率通常很低,这也限制了CRISPR/Cas9基因编辑工具从科研向应用的全面转化。
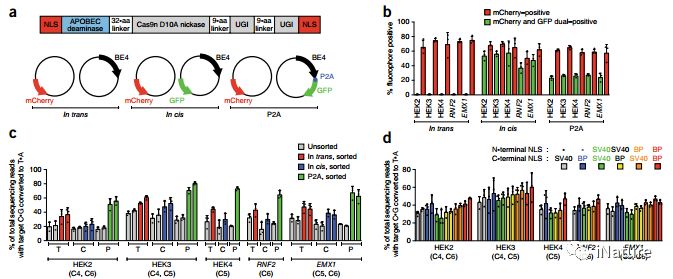
优化的流程
近期发展出的碱基编辑(base editing)系统,由CRISPR/Cas9和APOBEC胞嘧啶脱氨酶两个独立的体系整合而成,可在基因组靶向位点实现由胞嘧啶(cytosine, C)向胸腺嘧啶(thymine, T)的编辑改造。其中,BE4虽然实现了较高的C至T编辑效率,但是也伴随着较高水平的非目的性碱基插入或缺失(insertion/deletion, indel)和C至A或G的编辑副产物,这些都显著地降低了碱基编辑器在基础研究和临床上的深入应用。另外,对于改造的Cas9蛋白,表达量一直是一个瓶颈,故急切地需要解决这个问题。
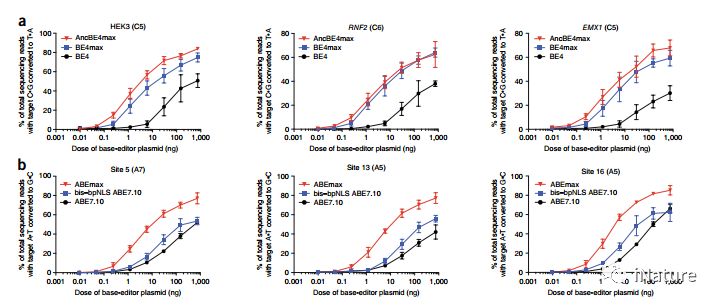
优化的碱基编辑器
David Liu研究组 通过修饰核定位信号(NLS)和密码子使用以及脱氨酶组分的重构来优化胞苷(BE4)和腺嘌呤(ABE7.10)碱基编辑,由此产生的BE4max,AncBE4max和ABEmax编辑器可以在各种哺乳动物细胞类型中纠正致病性SNP,并大大提高效率。
原文链接:
https://www.nature.com/articles/nbt.4172
3.Evolved Cas9 variants with broad PAM compatibility and high DNA specificity

2018年3月1日,David R Liu 研究组在Nature发表题为“Evolved Cas9 variants with broad PAM compatibility and high DNA specificity”,该论文发现经过改造后的Cas9蛋白可以在基因组中的更多位点上起作用,并且具有更少的脱靶的影响。这些发现扩大了CRISPR系统的DNA靶向范围,并确定在Cas9编辑效率,PAM兼容性和DNA特异性的关系。由于这文章具有重大突破性,Nature进行了专门点评。另外这是继David Liu前期使用CRISPR技术进行记录细胞内事件之后的又一巨作。

在实验室修改的酶允许研究人员修改基因组中更多的位点来提高CRISPR-Cas9基因编辑的实用性,同时还可以降低副作用。
这些特征可能使这种称为xCas9的酶成为实验室主食主打作品,他是哈佛大学布道研究所和马萨诸塞州剑桥麻省理工学院的化学生物学家David Liu说的。但他补充说,在其全部潜力变得清晰之前,需要进行更多的测试。这项研究今天在Nature上发表。
自从五年前推出以来,CRISPR-Cas9基因编辑已成为全球许多生物实验室的关键工具。该技术使研究人员能够比以前的方法更容易地在特定位点对基因组进行改变,但它仍然有一些令人沮丧的局限性。
一种是需要在要修改的位点旁边有一个称为PAM序列的特定DNA序列。自然界中发现的不同Cas9酶需要不同的PAM序列。最常用于实验室的Cas9是从细菌化脓链球菌中分离出来的,它的PAM允许研究人员在基因组中每十六个位点中就有一个靶点。
这对于许多应用来说已经足够了:例如,研究人员可以选择该基因中的许多位点进行编辑。但是,当研究人员试图做出非常具体的改变时,PAMs会变得受到限制,德国斯图加特大学的生物化学家Albert Jeltsch说。
这可能包括正在研究特定DNA序列或特定DNA字母的化学修饰如何影响基因表达的研究人员。 Jeltsch说:“从PAM限制中获得的突破非常重要。 “其中一些元素非常小,然后限制可能非常相关。”
分子剪刀的革命
为了找到解决办法,David Liu和他的同事们利用一种方法,迫使Cas9在实验室中迅速发展,积累突变,允许它在各种PAM位点旁切割。最终,他们最终获得了xCas9,它可以在广泛的PAM位点附近的位点切割DNA,并且可以靶向基因组中四分之一的位点。
该团队在基因组中的几十个位点上测试了它的酶,并将其与称为碱基编辑器的工具组合,以允许它将一个DNA字母换成另一个。
加利福尼亚大学圣地亚哥分校的生物工程师Prashant Mali说,同样的方法可以用来改变Cas9酶的其他变体,包括一些希望用于基因治疗的相对较小的Cas9蛋白质。他说,那些蛋白质往往具有令人沮丧的限制性PAM序列。
加利福尼亚斯坦福大学的合成生物学家斯坦利齐称这项工作“令人眼花缭乱”,并表示他的团队渴望在实验室中尝试它。 “我很惊讶新型Cas9具有更广泛的PAM识别和更高的特异性,”他说。 “这是惊人的生物学。”
原文链接:
https://www.nature.com/articles/nature26155
https://www.nature.com/articles/d41586-018-02540-x
4.Rewritable multi-event analog recording in bacterial and mammalian cells


飞机飞行记录仪和身体照相机可以帮助调查人员理解复杂的事件。 研究细胞的生物学家试图建立他们自己的数据记录器,例如通过将感兴趣的基因的活性与制造荧光蛋白的基因联系起来。 他们的目标是确定诸如癌症出现,衰老,环境影响和胚胎发育等过程。 革命性基因组编辑工具CRISPR借鉴的一种新型细胞记录仪现在提供了一种更好的捕捉DNA的数据的录制设备。
在今天的Science杂志中,哈佛大学的化学家David Liu和博士后Weixin Tang展示了他们称之为CRISPR介导的模拟多事件记录装置或CAMERA的两种形式。在初始验证实验中,他们在细菌和人类细胞中都显示了这种工具如何记录光照,抗生素和病毒感染或记录内部分子事件。 “这项研究突出了人们利用CRISPR中的发现创造这些合成途径的真正创新方式,”加州大学伯克利分校的蛋白质工程师Dave Savage说。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发