张小田教授:免疫治疗新药频出 I期研究即登陆ASCO大会
| 导读 | 无论从临床研究、转化研究抑或临床实践,免疫治疗(IO ,immuno-oncology)已成为彻底颠覆传统治疗手段的抗肿瘤治疗策略.本届... |
无论从临床研究、转化研究抑或临床实践,免疫治疗(IO ,immuno-oncology)已成为彻底颠覆传统治疗手段的抗肿瘤治疗策略。本届ASCO年会中,IO治疗在肺癌、黑色素瘤等疗效优势瘤种继续大放异彩,捷报频频。同时新药物研发、疗效相关标志物探讨、联合治疗模式、疗效评价等都是2018 ASCO的重头戏。在Hall D2的教育专场(immunotherapy biomarkers,beyond PD-L1)以及口头报告专场(developmental therapeutics-Immunotherapy)场场爆满一座难求,特别是在研新药虽然多处于I期阶段,但许多创新性理念得到与会专家的关注,期待突破。
 张小田教授
张小田教授
医学博士,北京大学肿瘤医院 主任医师,副教授,硕士生导师
北京大学肿瘤医院国际合作交流部副主任,内科教研室常务副主任
CSCO青年专家委员会主任委员
中国抗癌协会胃癌专业委员会青年委员 副主任委员
中国抗癌协会肿瘤营养治疗与支持委员会委员 秘书长 化疗营养学组 组长
中国临床肿瘤学会肿瘤营养治疗专家委员会委员
中国医师协会循证医学专业委员会营养学组组员
中国临床肿瘤学会执行委员会委员
中国老年学会老年肿瘤专业委员会胃肠分委会常务委员
中华医学会临床流行病学分会第六届委员会循证医学学组委员
Abstract 3000: ICONIC study(ICOS激动剂)
JTX-2011是首个作用于ICOS(Inducible CO-Stimulator of T cells)的IgG1抗体,是一种ICOS激动剂。ICOS表达于T细胞并与Ipilimumab疗效较好相关,转移性黑色素瘤经Ipi治疗后,ICOS可以表达上调,ICOS阳性者与阴性者OS分别为20个月对比8.1个月,因此ICOS可作为联合治疗的理想靶点。JTX-2011与ICOS结合后,激活并促进T效应细胞的增殖,同时选择性减少了肿瘤内Treg细胞。
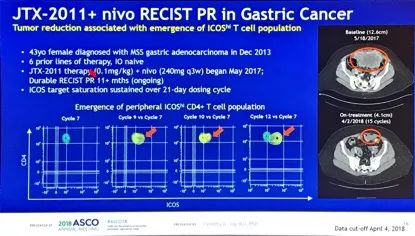
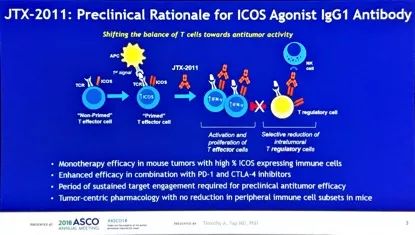 ICONIC 1/2期临床研究的两个队列(单药组,及联合Nivolumab组)除探索安全性及RP2D外,在探索性研究终点中,也关注了外周血基因印迹及免疫细胞亚群,在组织学标本中探讨ICOS表达以及基因印迹是否可以作为疗效预测标志物。在2期研究中富集了ICOS高表达肿瘤(NSCLC、胃癌、头颈部鳞癌,及其他实体瘤,如有FDA批准的抗PD1治疗适应症,需在抗PD1治疗失败后方可入组)。最终1期和2期分别入组40例及27例患者,研究确定了JTX-2011的给药剂量为0.3mg/kg(单药及Nivo联合剂量),在1/2期研究中均显示了良好的安全性。单药组总体疾病控制率(DCR)为25%(1期)及19%(2期),联合Nivo组的DCR分别为29%(1期)及32%(2期)。研究同时发现,组织学ICOS高表达,外周血新出现ICOS hi CD4+ T细胞是预后较好的标志物。在2例晚期胃癌多线治疗后的患者获得了明显的肿瘤退缩,疾病控制分别大于8.5个月及11个月。后续研究将纳入与ipilimumab的联合治疗,以及确认上述疗效预测标志物的价值。
ICONIC 1/2期临床研究的两个队列(单药组,及联合Nivolumab组)除探索安全性及RP2D外,在探索性研究终点中,也关注了外周血基因印迹及免疫细胞亚群,在组织学标本中探讨ICOS表达以及基因印迹是否可以作为疗效预测标志物。在2期研究中富集了ICOS高表达肿瘤(NSCLC、胃癌、头颈部鳞癌,及其他实体瘤,如有FDA批准的抗PD1治疗适应症,需在抗PD1治疗失败后方可入组)。最终1期和2期分别入组40例及27例患者,研究确定了JTX-2011的给药剂量为0.3mg/kg(单药及Nivo联合剂量),在1/2期研究中均显示了良好的安全性。单药组总体疾病控制率(DCR)为25%(1期)及19%(2期),联合Nivo组的DCR分别为29%(1期)及32%(2期)。研究同时发现,组织学ICOS高表达,外周血新出现ICOS hi CD4+ T细胞是预后较好的标志物。在2例晚期胃癌多线治疗后的患者获得了明显的肿瘤退缩,疾病控制分别大于8.5个月及11个月。后续研究将纳入与ipilimumab的联合治疗,以及确认上述疗效预测标志物的价值。
Abstract 3001: varlilumab(抗CD27激动剂抗体)
CD27是TNF受体超家族成员之一,持续表达于多数T细胞,部分B细胞亚群及NK细胞,CD27激活可通过多种途径活化T细胞并促进其增殖。前期体外研究发现其联合抗PD-(L)1治疗后,T细胞的活性及数量均明显增加,且在淋巴瘤动物模型中显示了协同抗肿瘤作用。
 本研究亦为1/2期临床研究,为Varli与Nivo联合给药,1期阶段纳入多种实体瘤,探索剂量,2期阶段纳入18例结直肠癌及54例卵巢癌,其中结直肠癌纳入标准为所有化疗药物及靶向药物均失败者。总体ORR为5%,DCR为19-20%;其中一例结直肠癌患者获得了95%的肿瘤退缩,PFS为35个月以上,其生物学特点为MSI-high及高肿瘤突变负荷。收集并分析外周血标本显示,多数患者治疗后Treg明显下降,趋化因子CCL2、CCL4及CXCL9等显著上升;患者基线标本检测显示多为PDL1阴性或TILs阴性,但60%的卵巢癌患者治疗后再次检测显示PDL1和CD8Tils明显上升,且与疗效相关。治疗前后PDL1和CD8表达变化是本研究非常特殊的一个发现,后续将探讨这种转变的预测标志物。
本研究亦为1/2期临床研究,为Varli与Nivo联合给药,1期阶段纳入多种实体瘤,探索剂量,2期阶段纳入18例结直肠癌及54例卵巢癌,其中结直肠癌纳入标准为所有化疗药物及靶向药物均失败者。总体ORR为5%,DCR为19-20%;其中一例结直肠癌患者获得了95%的肿瘤退缩,PFS为35个月以上,其生物学特点为MSI-high及高肿瘤突变负荷。收集并分析外周血标本显示,多数患者治疗后Treg明显下降,趋化因子CCL2、CCL4及CXCL9等显著上升;患者基线标本检测显示多为PDL1阴性或TILs阴性,但60%的卵巢癌患者治疗后再次检测显示PDL1和CD8Tils明显上升,且与疗效相关。治疗前后PDL1和CD8表达变化是本研究非常特殊的一个发现,后续将探讨这种转变的预测标志物。
Abstract 3002: Hu5F9-G4(抗CD47单抗)
CD47是细胞表面一种重要的“自我”标志物,是调节巨噬细胞吞噬作用的重要信号,年轻红细胞表面高表达CD47,而衰老红细胞表面CD47表达下调,因此后者被巨噬细胞清除。多种肿瘤细胞表面高表达CD47,因此向免疫系统发出“don't eat me”的信号。
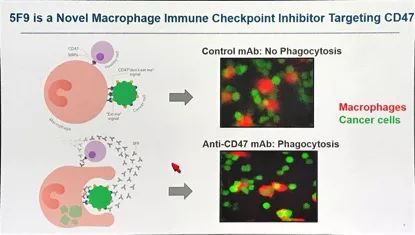 5F9是靶向于CD47的人源化IgG4单抗,与T细胞的免疫检查点拮抗剂作用相似,解除了失活体内免疫系统的抑制,在临床前研究显示其单药或与ICIs联合对多种恶性肿瘤有明显的抗肿瘤作用。在该项I期临床研究中,共纳入62例患者,确定RP2Ds为1mg/kg(d1)及后续30mg/kg(qW)。由于对红细胞破坏的影响,5F9首剂量仅为1mg/kg,仅有1/2级短暂急性贫血,13例卵巢癌患者中有2例有效且疾病控制长达23及41周以上,目前在卵巢癌中进行扩展研究。13例多线治疗后结直肠癌患者中有6例获得疾病稳定,中位PFS为18周,后续研究将联合PDL1单抗进行探索。
5F9是靶向于CD47的人源化IgG4单抗,与T细胞的免疫检查点拮抗剂作用相似,解除了失活体内免疫系统的抑制,在临床前研究显示其单药或与ICIs联合对多种恶性肿瘤有明显的抗肿瘤作用。在该项I期临床研究中,共纳入62例患者,确定RP2Ds为1mg/kg(d1)及后续30mg/kg(qW)。由于对红细胞破坏的影响,5F9首剂量仅为1mg/kg,仅有1/2级短暂急性贫血,13例卵巢癌患者中有2例有效且疾病控制长达23及41周以上,目前在卵巢癌中进行扩展研究。13例多线治疗后结直肠癌患者中有6例获得疾病稳定,中位PFS为18周,后续研究将联合PDL1单抗进行探索。
上述3个药物中,前两者旨在激活T细胞并促进增殖,后者为解除免疫抑制,作用机制各有不同,但都有与现有ICIs联合的理论机制,无论是单药或联合治疗均值得期待。从优效人群筛选来看,获益人群均具有明显免疫特点或分子生物学特点,如ICOS等相关标志物表达、外周血免疫细胞亚群改变、PDL1/CD8表达上调等;从治疗获益看,肿瘤退缩往往伴随非常长的疾病控制时间,这也是免疫治疗真正获益人群的特点。我们一方面要筛选出这类人群,同时还应该对其进行细致管理,包括免疫治疗持续时间、起始时机、联合治疗方式等。
在本专场中,还包括3项细胞免疫治疗的报告,B细胞淋巴瘤的Axi-cel(抗CD19 CART)、HPV相关疾病的HPV-Tils输注、黏液/圆细胞脂肪肉瘤的NY-ESO-1c259 TCR,也在I期研究中积累了安全性和疗效探索的数据,相信在未来的2期或3期研究中会有所斩获。
总之,在胃肠道肿瘤如胃癌中,化疗药物的疗效已达平台,抗her2及非Her2靶点的探索也面临瓶颈,上述在研新药从不同角度探索不同机制,特别是ICOS激动剂在胃癌患者的初步疗效令人期待,期望未来能够在III期研究中得以验证。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发