《自然》子刊:科学家首次发现肺癌细胞可利用免疫细胞促进凝血,借势转移和侵袭
| 导读 | 科学家首次发现肺癌细胞可利用免疫细胞促进凝血,借势转移和侵袭 |
战斗力强大又狡诈异常,这样的敌手相信谁都会头痛无比……不过如果面对的是癌症,真是硬着头皮也要上啊。但是人体内的队友们,你们能不能给点儿力呢?就算不帮忙也不要帮倒忙啊,这是抗击外敌不是内战,搞什么“天下无人不通癌”呢?
而最让科学家们咬牙切齿的,莫过于那些里应外合的人体免疫细胞了。在近期的《自然通讯》上,北卡罗来纳大学的研究团队又报告了它们资敌的新手段:被招募到肺癌微环境中的单核细胞可以大量释放凝血因子,给癌细胞提供顺风车,帮助它们转移到远处器官[1]!
癌症转移的危害,应该不用奇点糕多说了吧……
原本是帮助伤口止血的凝血机制,怎么就被癌细胞当成转移的新途径了呢?这还得说到风风光光的免疫检查点抑制剂。
以Opdivo和Keytruda为代表的PD-1抑制剂,这几年掀起了变革晚期肺癌治疗的大潮,即使是对近20年治疗手段未获进展,占肺癌发病总数高达30%的晚期肺鳞癌,PD-1抑制剂也体现了良好的效果[2]。不过医生们发现,虽然同是肺鳞癌患者,治疗效果也有好有坏,这是否还有更深层的原因呢?
第一个被怀疑的肯定是基因方面的因素。不久前奇点糕们介绍过,刷屏顶尖期刊的癌症基因组图谱(TCGA)计划:《细胞》超级重磅:十年一剑!26篇顶级论文绘制泛癌图谱,集科学之力开创癌症研究新世界! | 科学大发现

外行看热闹,内行看门道,这一张张图谱之中也许藏着的就是抗击癌症的终极密码
正是借助TCGA计划绘制的图谱,科学家们发现,肺鳞癌又可以分出四种在基因层面迥异的亚型[3-4]:经典型、基底型、原生型和分泌型,其中分泌型的患者预后相对最差,这引起了北卡罗来纳大学研究团队的关注。
利用TCGA数据库中的资料,研究团队逐个分析了分泌型肺腺癌中测到表达水平升高的403个基因,有两个基因表达水平升高让研究人员颇感意外——白细胞抗原CD14和趋化因子CCL2。
CCL2是癌细胞“喊”单核细胞等免疫细胞到肿瘤微环境中的工具,而白细胞抗原CD14恰恰是单核细胞和巨噬细胞表面最常见的标志物蛋白。事出反常必有妖,这两个基因表达升高,意味着有大量单核细胞被癌细胞召唤到肿瘤微环境中,它们与患者的预后差脱不了干系。
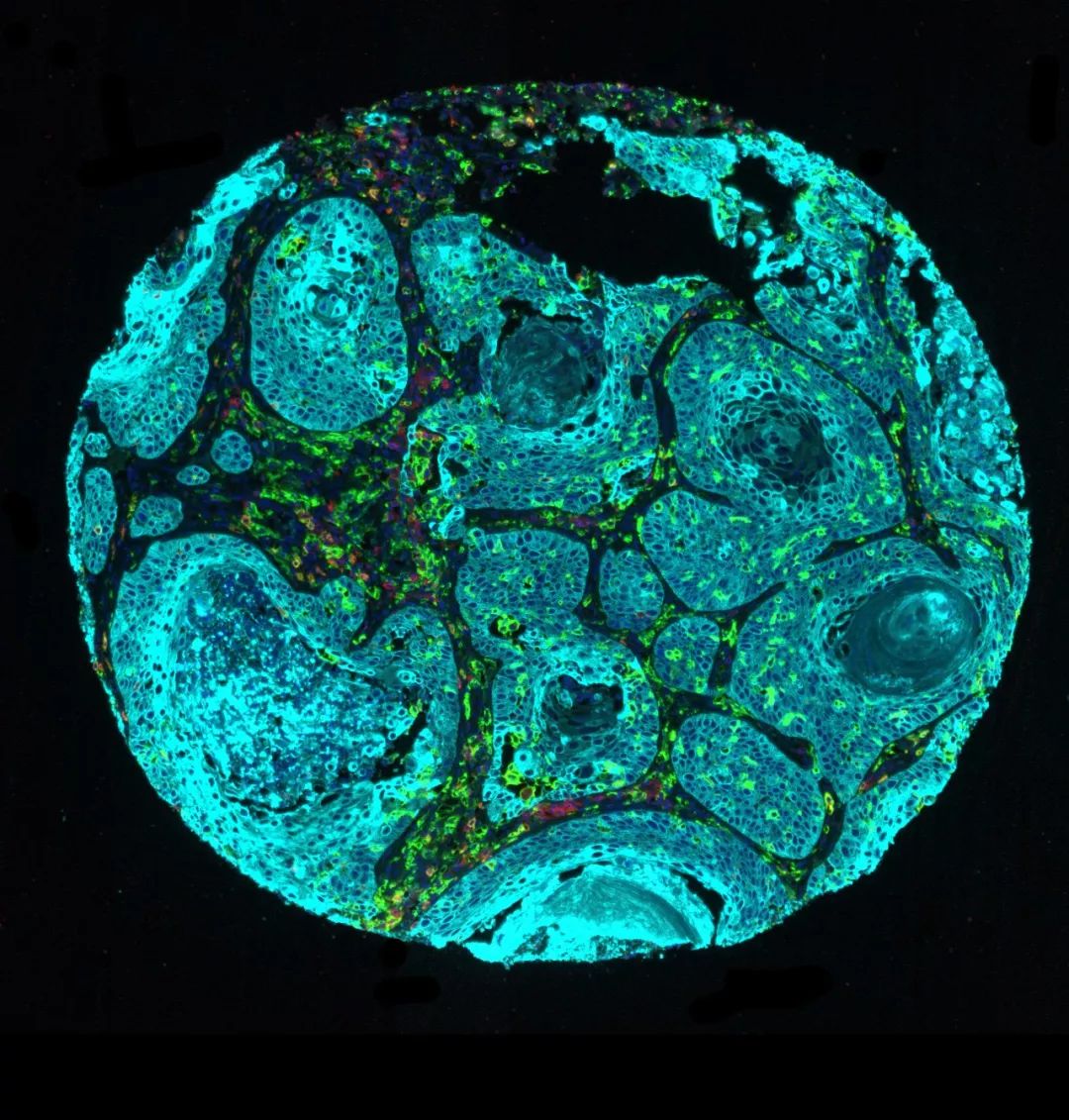
图中浅绿色的部分就是CD14表达阳性的细胞,在肿瘤中穿梭不息
小鼠模型上的实验显示,切断趋化因子CCL2的通路之后,肺腺癌的转移就大幅减少,看来这些被趋化因子招募来的单核细胞确实不怀好意。到底是什么原因让本该调节免疫功能,抑制癌症转移[5]的单核细胞堕落了呢?
在比较脾脏中固有的“好”单核细胞[6]和本次发现的“坏”单核细胞时,研究团队发现了一种转录水平翻了2.5倍的多肽——F13a1,而它是人体凝血因子FXIII的组成部分。在显微镜下,研究人员看到,单核细胞周围出现了明显的纤维蛋白交联,这是凝血因子在出血时,帮助凝血的关键步骤。
但这放在癌症微环境中就不妙了,因为狡猾的癌细胞可以抓住机会,借助交联的纤维蛋白形成侵入性伪足(invadopodia)[7],这种伪足是癌细胞能够攀附到血管,从而转移到机体其他部位的关键性结构[8],而凝血形成的血栓,又给癌细胞的扩散送来了“顺风车”,癌细胞攀上血栓就可以在血管里一路狂奔啊!
别慢慢爬了,兄弟,我这会儿正叫顺风车呢~
所以单核细胞分泌的这些凝血因子,简直是大大的坏了,而且还有研究显示,凝血因子FXIII会妨碍NK细胞对癌细胞的杀伤,使癌细胞大摇大摆地从肿瘤中扩散出去[9]。因此研究团队表示,将对相关机制继续深入探索,从而找到掐断转移,改善癌症疗效的新药物[10]。
就算抗癌新药们凶悍如下山猛虎,如果人体内的队友,都像单核细胞这样不遗余力的帮助对手……想赢癌症真难,真难啊。
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发