美国FDA讲稿|质量源于设计(QbD)
| 导读 | EOP2(End-of-Phase 2的缩写),Ⅱ期临床试验结束会议,申请人与FDA之间在Ⅱ期临床试验结束召开的会议,用于申请人获取FDA关... |



与“首轮审评通过(first cycle approval )”相对的是多轮审评(multi-cycle review),大多数需要经过多轮审评的申请资料均在一个或两个关键方面出现重大缺陷,其中安全性、有效性资料存在的缺陷是影响首轮审评通过率的首要因素。
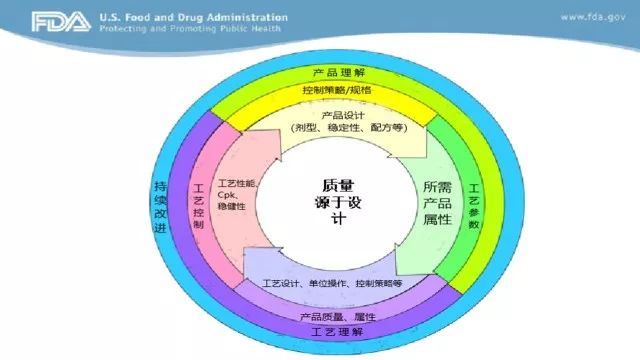
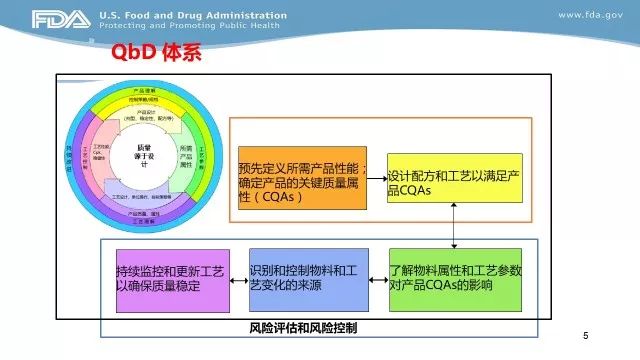

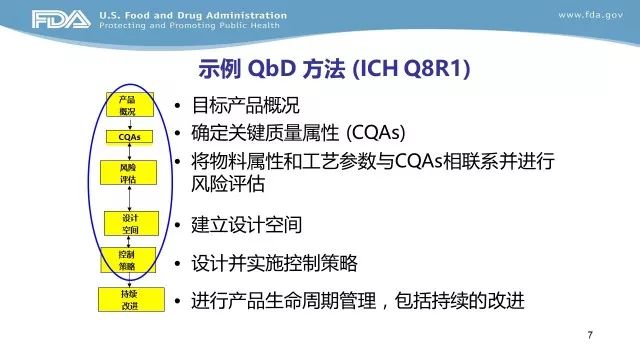




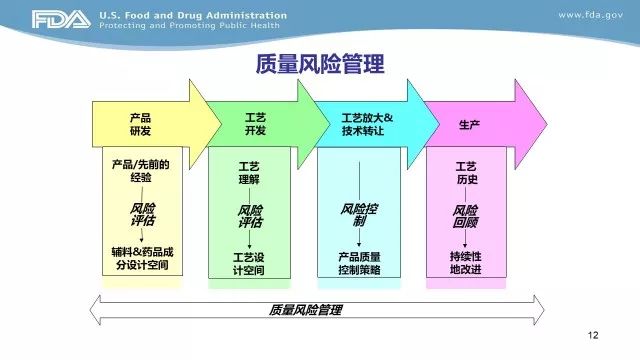



EOP2(End-of-Phase 2的缩写),Ⅱ期临床试验结束会议,申请人与FDA之间在Ⅱ期临床试验结束召开的会议,用于申请人获取FDA关于Ⅲ期临床试验的建议。
pre-NDA,新药申请前会议,在Ⅰ、Ⅱ、Ⅲ期临床试验结束后,申请人提交NDA之前,申请人与FDA之间的沟通会议,用于初步审核申请者将要提交的NDA资料是否充分、是否存在一些未解决的问题等。
CMC 特定会议,就药品的化学、生产、控制信息;研发状况及未来研发时间计划进行交流。









 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发