重磅 | 左建儒2篇Mol Cell文章,阐述NO的生物学功能
| 导读 | 2018年6月28号,中国科学院遗传与发育生物学研究所植物基因组学国家重点实验室左建儒研究组在Mol Cell在线发表题为“S-Nitrosylation Targets GSNO Reductase for Selective Autophagy during Hypoxia Responses in Plants”的研究论文,该论文揭示了S-亚硝基化介导GSNOR1选择性自噬的独特机制,从而建立了NO信号和自噬之间的分子联系 |
在2017年,左建儒发表了NO调节蛋白质的动态过程,发现在胁迫应答中NO正调控PRMT5的活性,那是通过Cys-125的亚硝基化作用。在prmt5-1的突变体中,PRMT5 C125S点突变的转基因,可以完全恢复发育表型,但是在胁迫应答及NO应答方面是不能被恢复的,而且,在 PRMT5 C125S /prmt5-1植株里面,盐诱导的精氨酸的二甲基化作用被消除了,这和pre-mRNA的异常剪切相关联。总的来说,胁迫诱导产生的NO传递到PRMT5上,进而调节蛋白质的甲基化作用。
一氧化氮(NO)是涉及动物和植物的各种发育过程和应激反应的关键信号分子。 NO的主要生物活性通过S-亚硝基化反应,通过将NO基团共价加到蛋白质的活性半胱氨酸巯基上形成S-亚硝基硫醇来实现。 S-亚硝基化是一种基于氧化还原的翻译后蛋白质修饰,可调节多种生理和病理过程。 类似于其他翻译后修饰,S-亚硝基化通过不同机制调节蛋白质活性,包括改变的靶标的构象,稳定性,亚细胞定位,生物化学活性和蛋白质 - 蛋白质相互作用的改变。
在高等植物中,主要涉及防御反应,应激反应和植物激素信号转导的有限数量的S-亚硝基化蛋白质已被功能性表征。在生物和非生物应激反应中,活性氧(ROS)和NO的爆发及其相互调节对于早期信号传导至关重要,其中S-亚硝基化已经显示出调节参与ROS稳态的关键酶的活性。 S-亚硝基化和脱亚基化的动态过程主要由细胞内S-亚硝基谷胱甘肽(GSNO)(一种主要的生物活性NO物质)的水平调节。 GSNO被高度保守的GSNO还原酶(GSNOR)不可逆转地降解。拟南芥基因组含有一个单拷贝的GSNOR1基因,也被称为SENSITIVE TO HOT TEMPERATURE5(HOT5)或PARAQUAT RESISTANT2(PAR2),它们分别从耐热性缺陷和氧化胁迫抗性突变体的遗传筛选中鉴定出来。 GSNOR1 / HOT5 / PAR2中的突变引起细胞内NO水平的显著增加和蛋白质组范围增加的S-亚硝基化,导致具有严重发育缺陷和改变对生物和非生物胁迫的响应的多效性表型。然而,高度保守的GSNOR蛋白质的调节机制在任何生物体中都很难理解。
在真核生物中,自噬是高度保守的机制,其将大分子和细胞器再循环至液泡或溶酶体以降解和再利用。这种回收过程对于正常生长条件下的细胞稳态和胁迫条件下的存活都是重要的。自噬在植物中的主要作用涉及营养胁迫,因为对碳和氮饥饿的超敏反应是自噬相关(atg)突变体的典型表型。通过形成称为自噬体的双膜结构来启动自噬,所述自噬体包含预定用于降解的蛋白质或细胞器(货物),然后将自噬体与空泡或溶酶体融合。尽管自噬被认为是非选择性降解过程,但新出现的证据表明存在各种形式的选择性自噬。选择性自噬是由与货物和ATG8蛋白相互作用的受体或衔接蛋白介导的。在此过程中,ATG8相互作用基序(AIM)是一种四氨基酸序列(W / YXXL / V / I; X指任何氨基酸),对于自噬受体和ATG8蛋白之间的特异性相互作用是必不可少的。
最近的研究表明,翻译后修饰通过调节底物特异性和结合亲和力,在调节选择性自噬方面发挥重要作用。在哺乳动物细胞中,p62 / sequestosome1和OPTN的磷酸化和泛素化分别调节泛素化底物的选择性降解和线粒体的损伤。突变型亨廷顿蛋白的乙酰化促进其向自噬体的运输,促进其通过自噬清除。在秀丽隐杆线虫中,两种货物蛋白(PGL-1和PGL-3)的精氨酸甲基化对其与支架蛋白的结合和自噬降解至关重要。类似地,内质网伴侣蛋白BiP的N端精氨酸化靶向其选择性自噬降解。在拟南芥中,选择性自噬受体PRN10促进了26S蛋白酶体的自噬降解。迄今为止,在选择性自噬过程中翻译后修饰的调节作用和精确的分子机制尚不清楚,特别是在植物中。
在动物和植物中,当氧气(O2)有限时,例如植物的水淹,缺氧可迅速诱导自噬。已知植物中的缺氧反应受N末端规则途径调控,参与ERFVII转录因子的降解。这类小分子转录因子含有Met-Cys N端,Met残基在O2和NO存在下被Met氨肽酶特异性去除。然后将暴露的Cys残基氧化成由植物CYS氧化酶(PCO)酶催化的Cys-亚磺酸或Cys-磺酸,接着进行精氨酸化并最终成为蛋白酶体降解的靶标。 ERFVII转录因子可直接感应NO,从而促进其在各种生理过程中的靶向蛋白水解。
最近的研究表明,重组PCO的双加氧酶活性直接催化合成的短肽的Cys-亚磺酸,覆盖含有N-Cys的ERFVII转录因子的残基2-11,其不需要事先的Cys-亚硝基化或外源NO。尽管如此,在没有O2或NO的情况下,N-Cys的氧化被抑制,导致ERFVII转录因子的稳定化。这些发现强调了参与NO,自噬和缺氧的信号通路之间的活跃相互作用,它们调节一系列复杂的生理和病理过程。
在这项研究中,中国科学院遗传与发育生物学研究所植物基因组学国家重点实验室左建儒研究组报告说NO介导的GSNOR1的S-亚硝基化引起局部构象变化,使其AIM可被ATG8接触,从而诱导GSNOR1的选择性自噬以调节缺氧反应。
原文链接:
https://www.cell.com/molecular-cell/fulltext/S1097-2765(18)30398-8
----华丽分割线----

真核生物细胞发育及胁迫应答过程会涉及产生活性氧及氮类化合物,包括自由基NO,这分子是可以作为短程或者是长程的信号分子。其中NO一个主要的信号转导机制是可逆的结合蛋白中的Cys,形成氧化还原敏感的S-nitrosothiol (SNO) 翻译后修饰。S-亚硝基化(S-nitrosylation)经常影响蛋白质的活性,定位,结构,相互作用模式。因此,NO被发现调控不同细胞的信号过程,基因表达。最近,S-亚硝基化作用同其他几种翻译后修饰相互作用,因此也丰富了细胞信号调控的内容(Skelly,2016)。
精氨酸甲基化是非常重要的一种蛋白质翻译后修饰,对于转录的表观调控,pre-mRNA的剪接,DNA损伤修复,mRNA翻译过程至关重要(Blanc and Richard, 2017; Liu et al., 2010)。精氨酸甲基化由一群蛋白质精氨酸甲基转移酶进行催化产生。 在植物里面,根据催化活性,可以分为二类 。类型I的可以产生不对称的二甲基精氨酸,类型II的可以产生对称的二甲基精氨酸 。PRMT5 是类型II的精氨酸甲基转移酶,可以与不同的底物相互作用以及甲基化底物,包括组蛋白及非组蛋白。在高等植物里面, PRMT5调节大量的生理学过程,包括开花时间,生长速率,叶子形态发育,生物钟以及胁迫应答 (Bedford and Clarke, 2009)。PRMT5突变引起多种生理表现及对NaCl超级敏感,这和pre-mRNA的异常剪切相关联。尽管PRMT5涉及调控大量的生物学过程,但是PRMT5自身怎么被调控还是不清楚。
正如上面所说的,S-亚硝基化与蛋白质精氨酸甲基化都涉及调控胁迫应答,这暗示了这俩种翻译后修饰可能存在着交流。
在谈正文之前,先说一下 生物素转化实验(biotin-switch assay)的实验原理(Jaffrey,2001)。在蛋白质中,Cys可以存在三种形式,自由的巯基,二硫键及亚硝基硫酯,首先用化学物质MMTS使本来存在的巯基转化为甲基硫硫酯,然后使用抗坏血酸钠盐 【ascorbate sodium (Asc)】还原亚硝基硫酯,使其成为游离的巯基,之后就是使用HPDP-生物素与经过处理过的蛋白质中的游离的巯基反应,偶连上生物素,最后通过亲和素来纯化蛋白,用相应的抗体检测就行了。
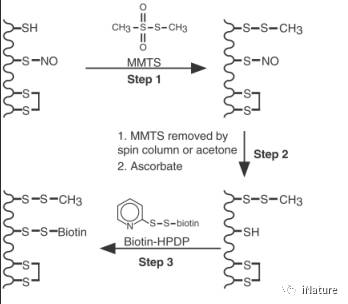
Fig.1 生物素转化实验
左建儒研究组在2015年通过蛋白质组学的方法,鉴定到了PRMT5可以被S-亚硝基化(Hu,2015)。为了确认这一结果,通过在体内及体外都发现PRMT5被S-亚硝基化(Fig.2)
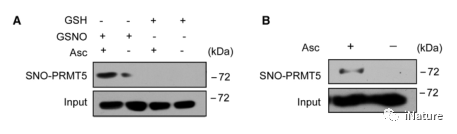
Fig.2 PRMT5被S-亚硝基化
通过体内的质谱学实验可知,PRMT5有3个位点可以被S-亚硝基化。由于C125很保守,故我们只是研究这个位点。在体内及体外把PRMT5 的125位氨基酸C转变成S,相比于正常的PRMT5,生物素转化实验的强度降低了25%(Fig.3)。以上结果说明,PRMT5的C-125可以被亚硝基化。
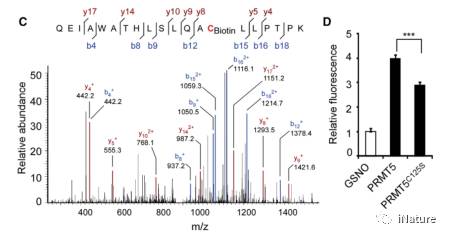
Fig.3 PRMT5的C125被S-亚硝基化
PRMT5的C-125被S-亚硝基化后,对其生物活性有什么影响了,通过体外的生化实验可知,可以明显的增加其精氨酸甲基化转移酶的活性(Fig.4),PRMT5作用的底物是H4,同理,myelin basic protein (MBP)及LSM4也出现类似的结果。
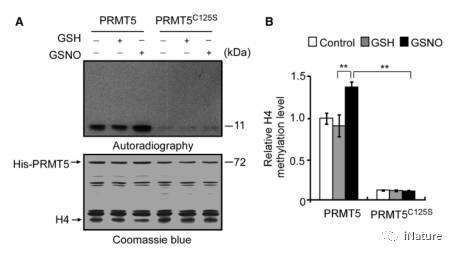
Fig.4 S-亚硝基化PRMT5,增强酶活性
现在想知道,PRMT5的C-125位点的S-亚硝基化在体内是否有生物学功能?通过PRMT5 C125S的转基因分析,它可以恢复prmt5突变体的发育缺陷。但是不能恢复对于胁迫应答的恢复(Fig.5)。相比于野生型的转基因,PRMT5 C125S的转基因组蛋白H4及剪接体一些成分的二甲基化修饰明显的下降,导致相关基因的失调控。
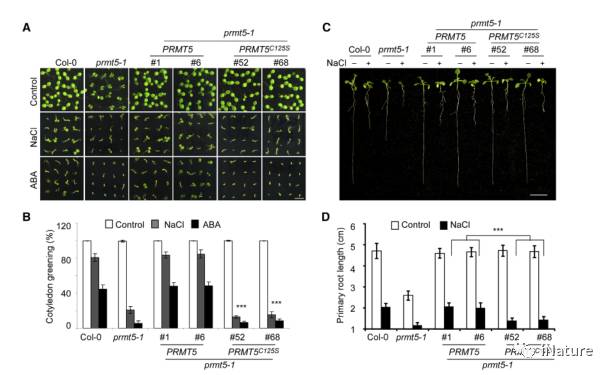
Fig.5 PRMT5 C125S转基因不能恢复胁迫应答过程
实际情况下,胁迫环境或者是gsnor1-3突变体里,可以增加NO的产生(Fig.6)。而NO的增加又可以使PRMT5的S-亚硝基化作用增强,之后就会促进其精氨酸甲基转移酶的活性,导致其底物的二甲基化,进而调节其功能。
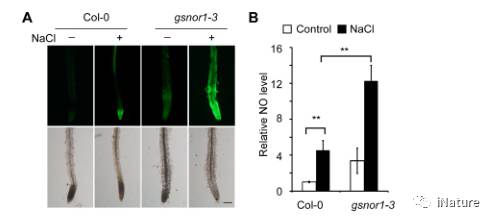
Fig.6 胁迫可以增加NO的产生
很有趣,在盐胁迫环境下,GSNO不敏感的现象被完整的PRMT5所互补,而不是PRMT5 C125S转基因(Fig.7),另外ABA也呈现了类似的现象。这些结果表明,GSNO诱导的 PRMT5 Cys-125的S-亚硝基化正调控胁迫应答(盐,ABA)。
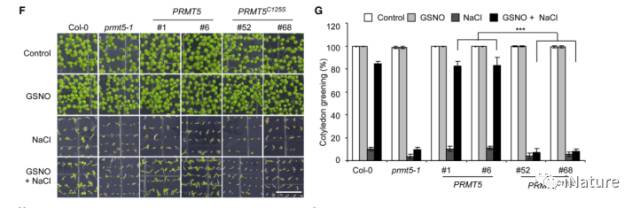
Fig.7 在胁迫下,PRMT5对于NO应答由 C125决定
总的来说,NO可以调控PRMT5甲基化酶的活性,进而产生相应的生物学功能。一般而言,蛋白被S-亚硝基化,会抑制其功能。但在这篇文章中,为什么PRMT5的C125 S-亚硝基化反而增加其酶的活性,这很耐人寻味?另外,为什么是PRMT5C125S就能恢复prmt5突变体的生理缺陷,而不能恢复胁迫应答作用?还有,PRMT5的S-亚硝基化可以存在于3个位点,其他俩个位点S-亚硝基化又有什么功能?这些都是值得探索。
话外篇
左建儒研究组与曹晓风研究组、鲍时来研究组、孔照胜研究组合作研究,发现了在植物应答胁迫的过程中,一氧化氮调控蛋白质甲基化研究的新机制,相关论文于2017年8月17日在Molecular Cell杂志发表(网络版于7月27日发表),并被该刊选为当期“Featured Article”,配发了题为“Modulating the Modulator: Regulation of Protein Methylation by Nitric Oxide”的专文评述。Molecular Cell杂志每期推选一篇“Featured Article”,并书面采访第一作者,旨在鼓励和褒奖青年科学家(Fig.8及9)。
Fig.8 该文章当选为Featured Article

Fig.9 Molecular cell 对第一作者的采访
Steven H. Spoel对本文进行了专门的评述:PRMT5涉及调控可变剪切,NO可能通过在胁迫条件下,通过PRMT5 S-亚硝基化 介导功能性的转录本调控以及产生新的可变剪接体。除了翻译后修饰的调控作用,NO同另外一些修饰交流进而影响蛋白质功能变化(Fig.10)。

Fig.10 Spoel对本文的评述
Spoel教授现在主要对生物体怎么应答环境的变化很感兴趣,而且Spoel教授也是个多产的学者,Spoel在Nature,Cell,Science,Plant Cell,PNAS 等顶尖杂志发表了上百篇文章,其领导的实验室在生物对于环境应答机制等方面的研究硕果累累,在国际上享有盛誉。
参考文献
Skelly, M.J., Frungillo, L., and Spoel, S.H. (2016). Curr. Opin. Plant Biol. 33, 126–132.
Blanc, R.S., and Richard, S. (2017). Arginine Methylation: The Coming of Age.
Mol. Cell 65, 8–24.
Liu, C., Lu, F., Cui, X., and Cao, X. (2010). Histone methylation in higher plants.Annu. Rev. Plant Biol. 61, 395–420.
Bedford, M.T., and Clarke, S.G. (2009). Protein arginine methylation in mam-
mals: who, what, and why. Mol. Cell 33, 1–13.
Jaffrey, S.R., and Snyder, S.H. (2001). The biotin switch method for the detec-
tion of S-nitrosylated proteins. Sci. STKE 2001, pl1.
Hu, J., Huang, X., Chen, L., Sun, X., Lu, C., Zhang, L., Wang, Y., and Zuo, J.
(2015). Site-specific nitrosoproteomic identification of endogenously S-nitro-
sylated proteins in Arabidopsis. Plant Physiol. 167, 1731–1746.(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发