基因治疗行业深度报告:从癌症到罕见遗传病
| 导读 | 从上世纪90年代兴起的基因治疗,经历了20多年的起伏,又重新受到广泛关注。2017年,伴随着两款CAR-T疗法和Spark公司的基因治疗产品在美国获批,更被认为是“基因治疗”之年。本文将通过以下内容,详细介绍基因治疗在全球范围内的进展和前景。 |
第一部分:介绍基因治疗的定义、发展历程、主要的分类,包括体内和体外基因疗法;
第二部分:详细介绍基因治疗在肿瘤领域的应用,主要是通过体外基因改造、培养T细胞,以CAR-T或TCR-T的形式,重新回输到体内,攻击癌细胞。CAR-T技术目前相对成熟,领先公司包括诺华、Kite等;TCR-T在实力瘤领域被寄予厚望,代表公司有Adaptimmune Therapeutics、Medigene等;
第三部分:详细介绍基因治疗在罕见遗传病领域的进展,除了已获批的Luxturna,其他领先的基因治疗产品包括:BioMarin针对血友病A的BMN270,AveXis针对脊髓型肌肉萎缩症的AVXS-101等;
第四部分:展示了我国基因治疗发展现状,CAR-T技术关注度最高,多家公司致力于该技术的研发,代表公司有南京传奇、恒润达生、科济生物、博生吉等。基因治疗在罕见病领域的应用,由于我国政策、医保覆盖等原因,还处在比较早期的阶段。
第五部分:展望未来,基因治疗作为一种新兴的生物科学技术,尤其是伴随着基因编辑技术的兴起,给癌症以及罕见病患者带来了新的希望。在我国,面对着竞争日趋激烈的CAR-T领域,创始人背景、科研实力、技术路径、靶点的选择、CAR-T的质量控制、工艺的稳定性等多方面因素将决定未来谁有可能胜出。
目录
一、基因治疗的发展历程和分类
1.1基因治疗近三十年的发展历程:从兴起,低潮再到重新崛起
1.2基因编辑技术的进步助力基因治疗
1.3基因治疗的分类
二、基因治疗在癌症领域的主要应用:CAR-T和TCR-T
2.1 CAR-T:肿瘤免疫治疗的热门技术
2.2 CAR-T疗法的代表公司:诺华
2.3 TCR-T:有望在实体瘤领域突破的肿瘤免疫疗法
2.4 TCR-T的代表公司:Adaptimmune Therapeutics
三、基因治疗在罕见病领域的应用:眼科、血友病、神经遗传性疾病等
3.1基因治疗在眼科领域的应用,代表公司Spark
3.2基因治疗在血友病领域的应用,代表公司:BioMarin
3.3基因治疗在神经遗传性疾病的应用,以及代表公司AveXis
3.4基因治疗在其他罕见遗传病领域的应用
四、我国基因治疗领域的发展
4.1 Car-T:我国基因治疗的热门领域
4.2我国基因治疗在罕见病领域:起步较晚、进展较慢
五、总结和未来展望
一、基因治疗的发展历程和分类
1.1基因治疗近三十年的发展历程:从兴起,低潮再到重新崛起
基因治疗:广义的基因治疗包括所有纠正、修复DNA缺陷的方法,从而达到疾病治疗的目的。早在上世纪90年代,科学家们已开始这样的尝试。上世纪90年代,四岁的阿香提患有重症联合免疫缺陷病(SCID),这是一种因为腺苷脱氨酶的基因缺陷导致的免疫系统几乎崩溃的罕见遗传病。美国的安德森医生和其他合作者,从阿香提体内提取白细胞,将正常的腺苷脱氨酶导入这些细胞,然后把基因改造后的白细胞重新输入病人体内,手术后的阿香提体内生产出了正常的腺苷脱氨酶。
阿香提的成功案例点燃了人们对于基因治疗的热情,之后多个国家多个科学家迅速投入到基因治疗的浪潮之中,很多人认为基因治疗的时代已经来临,一直到1999年,18岁的杰西在一项基因治疗临床试验中因为病毒载体引起的剧烈免疫反应不幸去世,给科学家们敲响了警钟,让人们重新审视基因治疗这项技术。
在此之后,基因治疗又出现了几例临床试验的失败,这些失败让基因治疗陷入了低潮期。一直到最近几年病毒载体安全性和有效性的不断改进,基因编辑技术的兴起等,基因治疗热度渐升。
2017年,更是被认为是基因治疗的突破之年,在这一年,两款CAR-T产品问世,同时来自Spark公司的具有跨时代意义的眼部罕见病基因治疗产品Luxturna获批在美国上市。从全球范围来看,目前获批的基因治疗产品主要有以下:
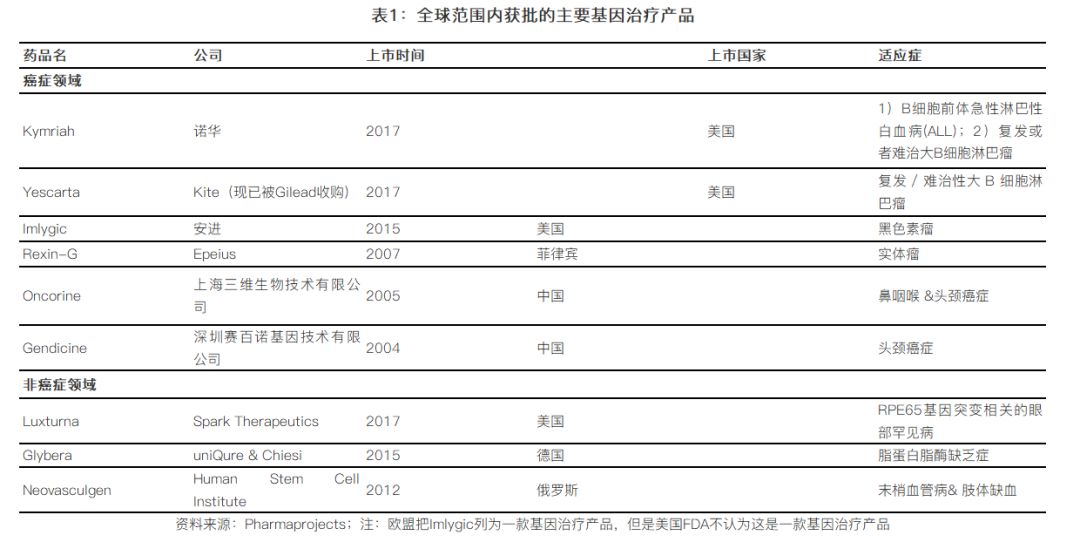
图1:1995-2016年积极开发的基因治疗项目的数量
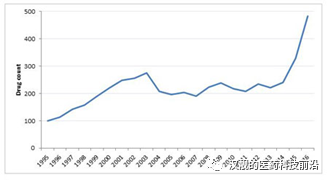
资料来源:Pharmaprojects(June 2016)
图1展示了1995年-2016年之间全球积极开发的基因治疗项目的数量,从2012年左右,积极开发的基因治疗的项目数量呈指数级提升,并在2016年达到了约500例,由此可见基因治疗行业经历了寒冬逐渐迎来曙光,并且发展迅速。
1.2 基因编辑技术的进步助力基因治疗
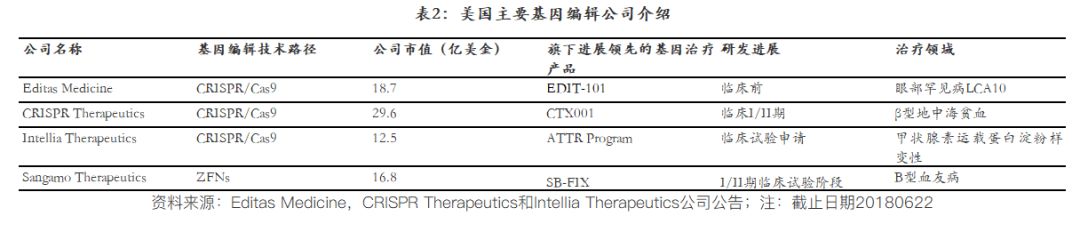
基因编辑技术的突破也在一定程度上力推基因治疗的发展,其中人工核酸内切酶介导的基因组编辑技术,主要包括三种:ZFNs、TALENs和CRISPR/Cas9技术。和传统基因工程中的病毒载体相比,基因编辑技术提供了一个精准的“手术刀”进行基因的增加,减少以及修改。尤其是以CRISPR/Cas9技术为核心的三大基因编辑公司:Editas Medicine,CRISPR Therapeutics和Intellia Therapeutics,陆续登陆美股,且这三大基因编辑公司均致力于基因治疗产品的研发,虽然目前还是在非常早期的阶段,但是给基因治疗未来的发展带来很多希望。
1.3 基因治疗的分类
基因治疗按照治疗方式,主要分为两大类:
1)体内基因治疗(In Vivo Gene Therapy):直接向血液或者目标器官中注射携带所需基因的载体。例如,Spark公司的Luxturna属于该类型;
2)体外基因治疗(Ex Vivo GeneTherapy):把患者的细胞从体内移出,通过在体外对于细胞进行基因改造,重新输入至患者的体内,例如体外基因改造对造血干细胞,以Bluebird在研的用于治疗镰刀型贫血症的基因治疗产品LentiGlobin为代表,或者对免疫T细胞的基因改造,包括CAR-T,TCR-T等。
基因治疗按照治疗领域分类,又可以细分为癌症,单基因罕见遗传病,心血管疾病,传染病等。同时根据Pharmaprojects在2016年的报告,癌症和罕见病是当前基因治疗临床研究最多的两个领域,如下内容将详细介绍这两个领域的基因治疗现状和前景。
图2:在研的基因治疗数量(按照疾病分类)
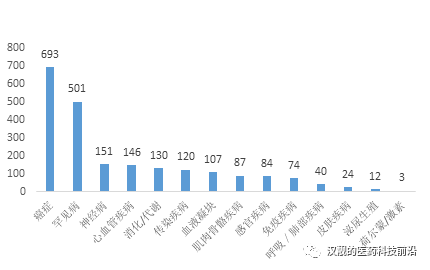
资料来源:Pharmaprojects(June 2016)
二、基因治疗在癌症领域的主要应用:
CAR-T和TCR-T
目前基因治疗在肿瘤领域的应用,主要是通过在体外基因改造T细胞,通过CAR-T或者TCR-T的形式,再把基因改造后的T细胞回输到患者体内,让改造后的T细胞攻击癌细胞,从而达到治疗肿瘤的目的。
2.1 CAR-T:肿瘤免疫治疗的热门技术
CAR-T(ChimericAntigen Receptor T-Cell),中文全称叫做嵌合抗原受体T细胞。简单地说,是通过基因改造技术,在T细胞(人体内一种重要的免疫细胞)上加入一个嵌合抗原受体,其主要是由胞外抗原结合区、跨膜链接区和胞内信号区三个部分组合,从而让免疫T细胞不仅能够特异性地识别癌症细胞,同时可以激活T细胞杀死癌症细胞。CAR-T技术治疗癌症的过程,主要是四个步骤:1)T细胞的收集、活化;2) T细胞的体外基因转导:通过基因工程技术,让CAR嵌合到T细胞上;3)构建好的CAR-T细胞的体外增值培养;4)CAR-T的回输和患者的观测。
图3:CAR-T细胞治疗流程
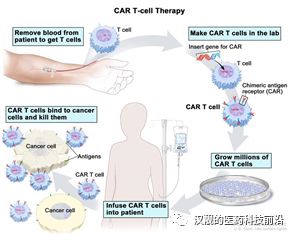
资料来源:National Cancer Institute
尽管CAR-T的理论由来已久,上个世纪90年代就有科学家提出,但是在过去的几年中,CAR-T技术突飞猛进,尤其是在2017年美国FDA批准了两款CAR-T治疗方案,分别是来自诺华和Kite(现在已经被Gilead收购)的Kymriah和Yescarta(如表1),除此之外,全球还有多家公司致力于CAR-T领域,代表公司包括:Juno(现已被Celgene收购)、Bluebird、Cellectis等。
2.2 CAR-T疗法的代表公司:诺华
早在1999年, Dr. Carl June和其团队在宾夕法尼亚大学已展开CAR-T研究。经过了十几年的努力,2012年,诺华宣布和和宾夕法尼亚大学合作,共同研发和商业化CAR-T免疫疗法,其中就包括了CTL019:一款以CD19为靶点的CAR-T肿瘤免疫疗法。同时在2012年,患有急性淋巴细胞白血病的美国7岁女孩艾米丽接受该CAR-T疗法,成为了世界上首个接受CTL019治疗的患者,艾米丽的癌症至今也没有再复发。
2017年8月,诺华宣布CTL019(商品名:Kymriah)获FDA批准用于25岁以下难治或者复发的B-细胞急性淋巴细胞白血病,也是全球第一款获批上市的CAR-T,其获批主要是基于一项全球临床多中心关键性临床试验数据(ELIANA Study)。
2018年1月,诺华更新了该试验数据。结果显示,对于接受CAR-T治疗的75名患者,在这之后的三个月或者更长时间的随访中,Kymriah展现出了整体的总缓解率达到81%。60%的患者达到了完全缓解(CompleteResponse, CR),同时21%的患者达到了CR,但血细胞计数恢复不完全。对于所有应答患者,没有检测出微小残留病,中位的随访时间是13.1个月。
2018年5月,诺华批准了Kymriah用于成人复发或者难治的大B细胞淋巴瘤,包括了非弥漫性大B细胞淋巴瘤,以及高度的B细胞淋巴瘤。
2.3 TCR-T:有望在实体瘤领域突破的肿瘤免疫疗法
TCR-T(T cell receptor-geneengineered T cells,TCR-T),中文全称是T细胞受体基因工程改造T细胞:通过基因工程的手段,直接改造T细胞识别肿瘤抗原的表面受体:TCR(T cell receptor:T细胞受体),从而加强T细胞识别和杀伤肿瘤细胞的能力。
尽管和CAR-T疗法一样,同属于肿瘤免疫治疗,也同样是体外对T细胞进行基因改造的基因治疗。但是和CAR-T疗法不同的地方在于:1)CAR-T疗法是在T细胞上构建一个嵌合型抗体受体,而TCR-T技术是改造T细胞的表面受体,增强其亲和性;2)和CAR-T只能识别肿瘤细胞表面抗原不同,TCR-T可以靶向细胞内或者细胞表面的肿瘤抗原,从而让TCR-T有了更多的靶点可供选择,尤其包括多个和癌症相关的细胞内抗原,这也是部分学者认为TCR-T在实力瘤领域具备巨大潜力的原因。
例如,肿瘤-睾丸抗原(Cancer-testis Antigen,简称CTAs),是一类发现于多种肿瘤组织内,但是正常细胞内较少出现的细胞质蛋白,被认为和很多癌症息息相关,而这一类的抗原,也成为了目前多款TCR-T疗法的目标靶点,包括NY-ESO-1, MAGE A4, MAGE A10等。
图4:TCR-T和CAR-T的区别
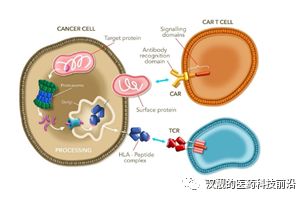
资料来源:Adaptimmune Therapeutics
当然,TCR-T疗法目前还存在不少挑战,尚未有一款产品获批,面对的困难包括:肿瘤微环境的抑制作用,脱靶毒性、神经毒性,以及和CAR-T治疗遇到的类似的CRS(细胞因子释放综合征)等等。目前积极从事TCR-T疗法开发的公司包括Adaptimmune、Medigene、Kite等。
Adaptimmune Therapeutics是英国的一家生物医药公司,成立于2014年,2015年登陆美国纳斯达克。公司的核心技术是其特有的TCR-T技术平台:SPEAR(Specific Peptide Enhanced Affinity Receptor)T细胞技术,可以对特定抗原增强T细胞亲和力,该技术平台的研发已有超过15年的历史。
图5:TCR-T疗法的步骤
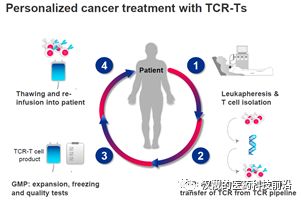
资料来源:Medigene
2.4 TCR-T的代表公司:Adaptimmune Therapeutics
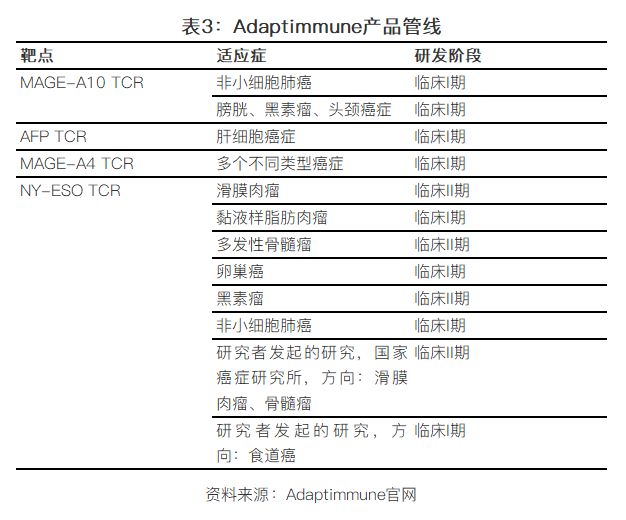
以该技术平台为基础,公司旗下有四款TCR-T治疗产品在临床阶段,分别以MAGE-A10, MAGE-A4, AFP 和 NY-ESO为靶点,涉足多个肿瘤类型,包括实体瘤和血液瘤。进度最领先的一款TCR-T疗法:NY-ESO TCR,已在多个癌症领域中进行临床试验,包括血液瘤领域的多发性骨髓瘤,实体瘤领域里的黑色素瘤,卵巢癌,非小细胞肺癌,滑膜肉瘤等。不过根据之前的条款,这款产品的全球权利已经授权给GSK。
三、基因治疗在罕见病领域的应用:
眼科、血友病、神经遗传性疾病等
全球确认的罕见病大约有7000多种,但仅有几百种罕见病拥有获批的治疗药物,基因治疗在罕见病领域意义重大,因为超过80%的罕见病是由单基因缺陷引起(资料来源:NIH)。对于罕见病,传统小分子药物,通常是通过减轻症状而发挥作用,与此相反,基因治疗拥有纠正基因缺陷的潜能,尤其对于单基因罕见病,提供一个潜在的治愈方案,而不是简单的管理症状。进一步来说,成功的基因治疗或许仅仅需要一次治疗,而不是终生的持续治疗。
3.1基因治疗在眼科领域的应用,代表公司Spark
遗传性视网膜病变(Inherited Retinal Diseases,IRDs)是一组罕见的眼睛疾病,由遗传性基因突变造成,常会导致视力丧失或者失明。IRDs又可以细分为视网膜色素变性(Retinitis Pigmentosa, RP),雷伯氏先天性黑曚(Leber Congenital Amaurosis,LCA),先天性静止性夜盲(Congenital Stationary Night Blindness,CSNB)等。由于IRDs大多由单个基因缺陷引起(由单个基因缺陷导致的IRDs的发病率大约是1/3000),同时因为眼睛是人体内相对独立的,容易进行治疗的器官,所以IRDs成为了基因治疗的热门研究领域。
以Spark公司为例,该公司成立于2013年,有超过20年的基因治疗研究基础,技术平台来源于费城儿童医院,2015年初,登陆美国纳斯达克。Spark公司2017年获批上市的Luxturna是一款用于治疗RPE65基因缺陷的遗传性视网膜病变,只需要一次性治疗。其中,RPE65基因编码的RPE65蛋白是我们的视觉系统中一种非常重要的酶,可以催化11-顺-视网膜(11-cis-retinal)异构化成为全反式视黄醛(All-trans-retinal),从而触发光传导通路(Phototransduction Pathway),最终让大脑皮质的视觉中枢产生视觉。Spark预计在全美以及欧洲主要五国的患者人数达到3500人。
Spark的Luxturna是通过AAV病毒(腺病毒相关病毒)携带正常的RPE65基因,进入到视网膜内,正常的RPE65基因并不整合到人体细胞的DNA中,而是在细胞核中合成正常的RPE65蛋白,从而帮助触发光传导通路,恢复正常的视觉功能。当然,除了Spark,Editas等其他公司的产品管线内都有在研的针对IRDs的基因治疗产品。
3.2基因治疗在血友病领域的应用,代表公司:BioMarin
基因治疗另外一个潜在的重要领域就是血友病。血友病主要包括血友病A和血友病B,都属于罕见的X染色体隐形遗传病,分别由于缺乏足够的凝血因子VIII和凝血因子IX两种蛋白,从而导致凝血功能异常,发生持续性出血,严重时可以影响生命。全球血友病联盟预测全球有超过15万人患有血友病A,接近3万人患有血友病B。BioMarin、Spark、Bioverative等公司都致力于研发血友病领域的基因治疗产品,以下以BioMarin公司为例。
BioMarin是一家美国上市的生物科技公司,旗下的基因治疗产品BMN270针对血友病A,和Spark一样,也是采用AAV病毒,目前已经进入临床三期。在17年美国ASH会议上,BioMarin公布了BMN270的最新数据,表明:对于注射剂量在6e13vg/kg的7名患者,在接受治疗的78周后,凝血因子VIII水平的中位数和平均数分别达到90%和89%,根据全球血友病联盟的定义,正常人的凝血VIII因子的水平在50%-150%之间。
同时,数据显示,在接受治疗的四周后,中位数的年化流血率(Annualized Bleeding Rate)以及凝血因子VIII的注射次数(Annualized FVIII Infusions)均为0,代表了没有出现流血现象和接受传统的替代疗法。该数据非常正面,让科研人员看到了基因治疗在未来可以彻底治愈血友病的希望。
3.3基因治疗在神经遗传性疾病的应用,代表公司AveXis
长久以来,基因治疗在治疗神经系统疾病挑战非常大,困难包括病毒载体的安全性,运送病毒载体的方式等。而如今,以上两个方面都取得了巨大的进步。尤其是科学家们发现AAV9病毒载体的相对安全性和有效性,以及可以穿过血脑屏障(Blood–Brain Barrier, BBB),成为了多个神经系统疾病基因治疗项目的首选载体,其中为代表的包括AveXis公司(已被诺华收购)。
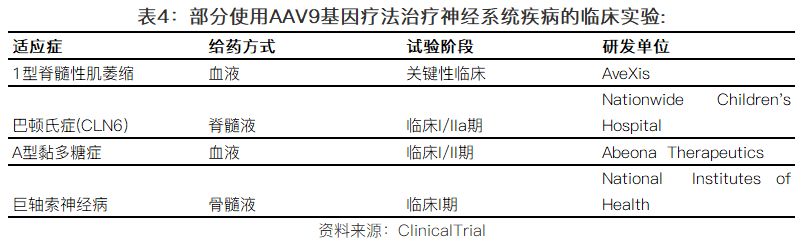
AveXis是美国的一家生物科技公司,成立于2010年,致力于开发罕见和致命的神经遗传疾病的基因治疗产品,2016年登陆美国纳斯达克。公司的主要产品AVXS-101是一款在研的用于治疗脊髓型肌肉萎缩症(Spinal Muscular Atrophy,又简称SMA)的基因治疗产品。
SMA是一种严重的神经肌肉疾病,由SMN1基因缺陷所致,发生率大约是每一万个新生儿童中有一个例患有该疾病。在AVXS-101基因治疗产品中,AAV9病毒载体被用于携带正常工作的人类SMN基因并通过静脉给药,被病毒携带进入细胞体内的SMN基因,并不整合到细胞原有的DNA分子内,而是通过转录和翻译,制造出合适水平的SMN蛋白。
AVXS-101已经完成针对SMA一型患者的临床一期试验(公开标签、剂量爬坡、用于衡量产品的安全性和耐受性),正在开展关键性临床试验(Pivotal Clinical Trial)。临床I期试验中,共入组了15名SMA一型婴儿患者,分为两组,一组是建议的剂量,入组了12名患者,一组是低剂量,入组了3名患者。在婴儿患者年龄达到13.6个月的时候,无事件生存率(Event-free Survival)达到100%。而相对应的文献数据显示,患者在13.6个月的时候,无事件生存率仅为25%。截止临床I期试验结束,对于建议剂量的12名入组患者,中位年龄是20.2个月,有9名患者可以至少5秒钟无需帮助的坐着。此外,该基因治疗方案展示了良好的安全性和耐受性。
3.4基因治疗在其他罕见遗传病领域的应用
基因治疗目前在研的罕见病还包括镰刀型贫血症、Beta型地中海贫血症、脂蛋白酶缺乏症、黏多糖贮积症、肾上腺脑白质失养症等,除了我们上述提到的基因治疗的公司,领先企业还包括Bluebird,uniQure、Sarepta、Tocagen等。
四、我国基因治疗领域的发展
4.1 CAR-T:我国基因治疗的热门领域
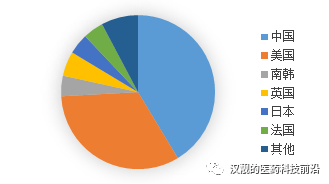
我国的基因治疗目前主要是集中在CAR-T领域,从全世界的角度来看,全球CAR-T研究的公司主要集中在中国和美国,两个国家从事CAR-T研究的公司占比超过80%。
图6:全球CAR-T公司地理分布
资料来源:Celltrials
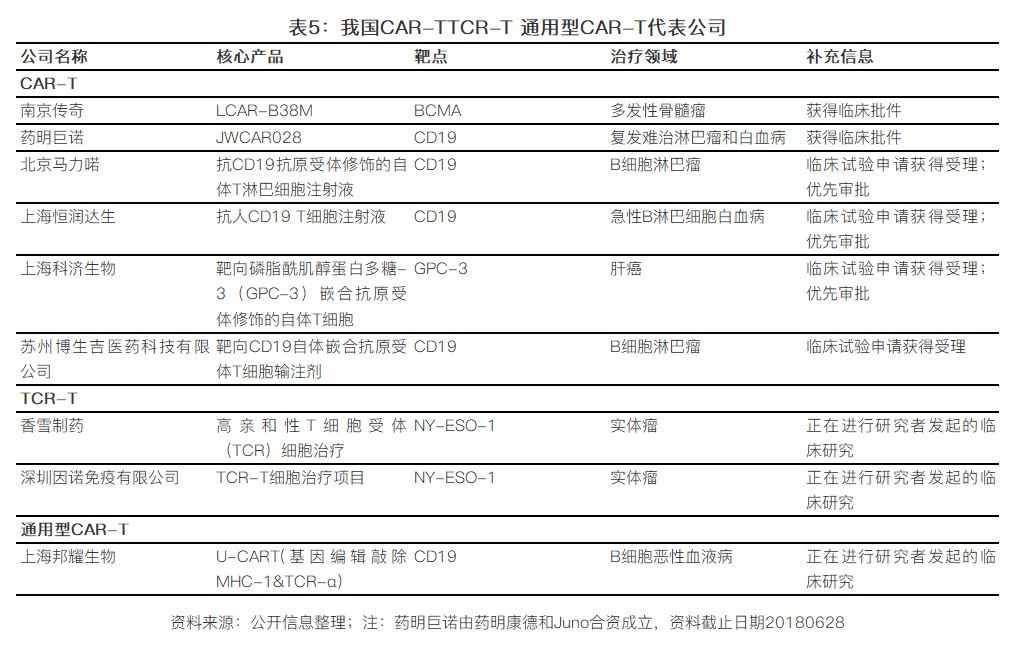
2016年12月,原CFDA(现在改名为:国家药品监督管理局,SDA)颁布《细胞制品研究与评价技术指导原则》,旨在规范和指导细胞治疗产品,并在2017年底正式推出《细胞治疗产品研究与评价技术指导原则(试行)》,按照药品研发以及管理规范对CAR-T等细胞治疗产品进行监管,明确CAR-T等细胞治疗产品的申报原则。同时,南京传奇生物的LCAR-B38M已经成功抢得国内首个CAR-T临床批件。除了南京传奇生物,我国从事CAR-T疗法的公司还包括优卡迪生物、北京马力喏、恒润达生、博生吉等,不过大部分还是集中在血液瘤领域,多以CD19和BCMA为靶点,布局实力瘤的包括科济生物等。与此同时,在监管层面,我国细胞治疗产业也开始走向正规。早在2009年,免疫细胞疗法作为第三类医疗技术进行管理,后在2015年7月卫计委决定取消第三类医疗技术临床应用准入审批。2016年的“魏则西事件”震惊全国,反应了我国在该领域一直存在着监管不严,乱象丛生的现状。
和全球趋势一样,我国从事TCR-T研发的公司较少,主要有香雪、因诺生物等公司致力于TCR-T技术的研发。另外,我国也已有公司开始把基因编辑技术应用到构建“通用型CAR-T”的研发过程中,例如上海邦耀生物, 但是还处在非常早期的阶段。
4.2我国基因治疗在罕见病领域:起步较晚、进展较慢
和美国基因治疗技术逐渐应用于罕见病不同,我国在罕见病领域的发展起步较晚,进展较慢,不利因素包括市场需求低、患者人数少、医保难以支付等问题。
但值得欣慰的是,一方面,国家政策对于罕见病的重视程度逐渐加大,在今年五月份,国家卫生健康委员会等五部门联合制定了《第一批罕见病目录》,包含了121种罕见病。另一方面,也可以看到我国有机构开始涉足罕见病的基因治疗领域,例如北京瑞希罕见病基因治疗技术研究所,虽然还是属于一个非盈利的科研单位,但致力于基因疗法在罕见病领域的应用,目前旗下两款在研药物,分别是针对SMA和粘多糖贮积症III A型。
五、总结和未来展望
综上所述,基因治疗行业经过20多年的摸索,目前正处在高速发展期。在癌症领域,对于T细胞的体外基因改造,以CAR-T形式对血液瘤的治疗取得的进展最快,2017年分别来自诺华和Kite的两款CAR-T获美国FDA批准,具有里程碑的意义。TCR-T作为另外一种备受关注的癌症领域的基因疗法,目前在实力瘤的应用被寄予厚望,代表公司包括英国的AdaptimmuneTherapeutics、德国的 Medigene等,不过还有待临床试验的进一步验证。
至于基因治疗在罕见遗传病领域的发展,欣喜地看到美国FDA已经批准了Spark公司针对眼部罕见病的Luxturna,同时基因治疗在血友病、神经系统疾病、镰刀型贫血症等多个罕见遗传都呈现积极的进展,领先公司包括BioMarin、AveXis、Bluebird等等。以CRISPR/Cas9为核心的基因编辑技术的兴起,美国三大基因编辑公司Editas Medicine、CRISPR Therapeutics和Intellia Therapeutics陆续登陆美股,更让基因治疗打开新的篇章。
我国基因治疗领域,CAR-T是目前最受关注,也是资本、科研等集中力量投入的方向,尤其是我国细胞治疗产业,经历了之前不规范的不利影响,已逐渐走上正规,多家公司,包括南京传奇、科济生物、优卡迪、博生吉、恒润达生等都已按照药物批准流程,申报临床试验,且南京传奇在多发性骨髓瘤领域的LCAR-B38M已获得临床批件。
面对国内竞争日益激烈的CAR-T领域,未来谁会胜出,需要关注的因素包括创始人背景、科研实力、技术路径、靶点的选择、CAR-T的质量控制、工艺的稳定性等等。另外,我国基因治疗在TCR-T、罕见病等其他领域还处在比较早期的阶段,还需要科研数据的进一步验证,但也是目前值得关注的方向。总之,无论国外还是国内,基因治疗作为一种新型的生物技术疗法,给众多患者带来了前所未有的治疗手段,带来了新的希望。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发