本应提前10年上市的PD-1,就这样被搁置了......
| 导读 | 2014年7月全球首个PD-1抑制剂OPDIVO在日本上市,之后免疫抑制剂的研究热潮便一发不可收拾。熟悉的肿瘤免疫治疗的朋友会知道,CTLA-4抑制剂Yervoy®才是全球首个免疫检查点药物。聊起CTLA-4抑制剂Yervoy®,可以说全是眼泪,如果当年BMS没有延缓CTLA-4的药物研发,或许PD-1抑制剂OPDIVO早10年就上市了。 |
2014年7月全球首个PD-1抑制剂OPDIVO在日本上市,之后免疫抑制剂的研究热潮便一发不可收拾。熟悉的肿瘤免疫治疗的朋友会知道,CTLA-4抑制剂Yervoy®才是全球首个免疫检查点药物。聊起CTLA-4抑制剂Yervoy®,可以说全是眼泪,如果当年BMS没有延缓CTLA-4的药物研发,或许PD-1抑制剂OPDIVO早10年就上市了。故事是这样说的:
1免疫抑制剂前世与今生
法国人Pierre Goldstein在1987年无意中发现了T细胞上的一个分子CTLA-4,起初大家对这一分子并不在意,一直到1994年UCSF的JeffreyBluestone发现这一蛋白跟已经发现了n多年的共激活分子CD28是起相反作用的。不过他们都是纯免疫学家,不是肿瘤专家,没往肿瘤免疫方向去想,而原先在加州大学伯克利分校然后又挪去纽约纪念斯隆凯特琳癌症中心的James Allison教授却敏锐地意识到CTLA-4可能在肿瘤免疫里具有“非同凡响”的功能,Allison发现通过抑制这个CTLA-4,它能在动物肿瘤模型起到某种程度的抑制肿瘤作用,于是CTLA-4也就成为了第一个免疫检查点蛋白分子。而James Allison算是开启了通过抑制免疫检查点的途径来治疗癌症的肿瘤免疫治疗新篇章(再插一下,所以Allison是癌症免疫治疗最先的先驱,估计很大可能会拿诺贝尔奖)。
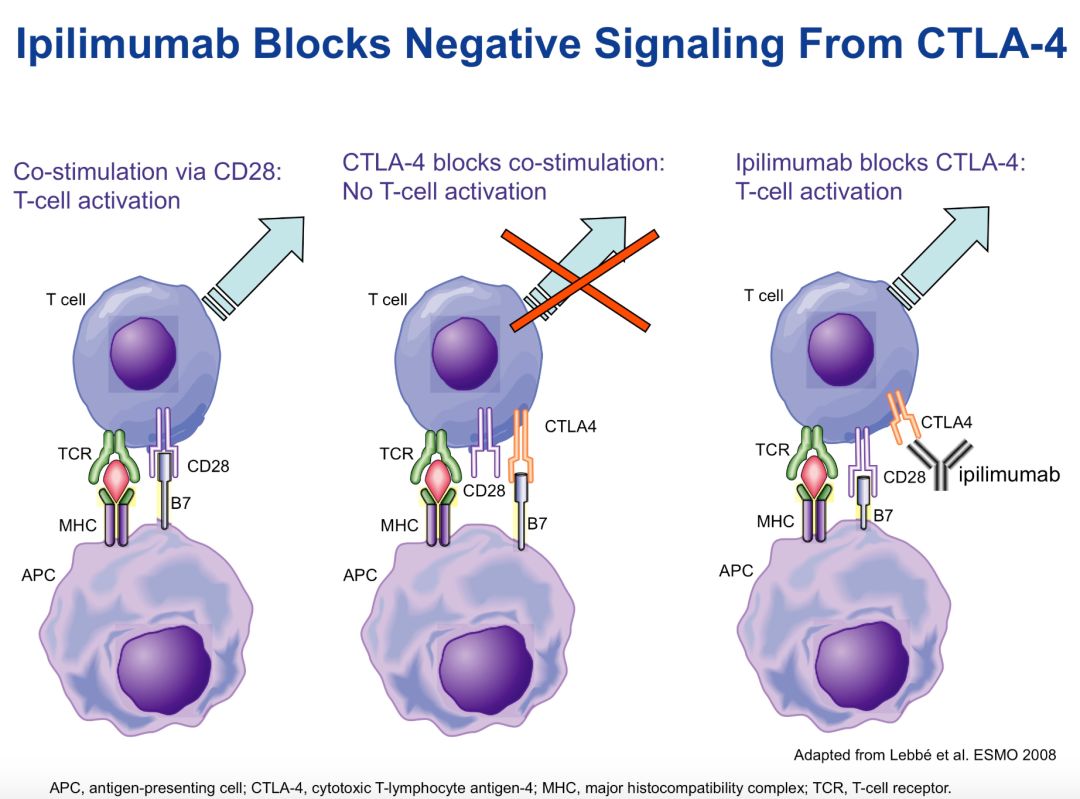
BMS开始研究CTLA-4蛋白分子对抗癌症的影响,可惜后来他们发现这只是一点曙光而已,因为这个分子是在T细胞上,而其配体(ligand)并不具备肿瘤特异性,阻断CTLA-4会激活全身免疫系统,副作用太强。
这时候遗憾的事情发生了,BMS公司在投入免疫疗法研发方向近十年之后失去了耐心,因为看不到大的希望,于1997年决定将西雅图研发部门关掉。某种程度上说,BMS公司当年对这一方向的不重视,某种程度上是拖延了免疫检查点药物的开发,否则这一类药物可能会早个10年问世。

不过好在科学家陆续发现的近十个免疫检查点,发现了真正具有肿瘤特异性的一个蛋白分子,也就是现在闻名天下的PD-1,从而掀起了验证通过抑制PD-1(或者PD-L1)是否能抗癌的研究新方向。2009年,BMS通过收购Medarex获得了ipilimumab。最终,美国FDA于2011年3月25日批准ipilimumab(商标名称为Yervoy)用于治疗晚期黑色素瘤。
2PD-1迅速火遍全球
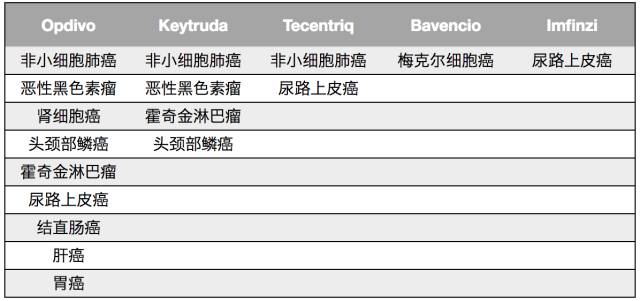
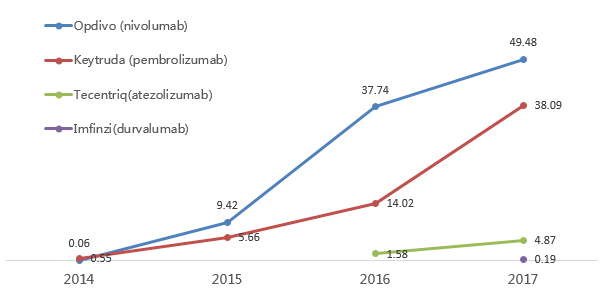
目前全球上市的5个 PD-1/PD-L1抑制剂均属于大分子抗体类药物。最亮眼的当属美施贵宝(BMS) 公司的 Opdivo,2016年已达到 46 亿美元的销售额。预计2020年整个PD-1/PD-L1类药物市场需求将超过数百亿美元。
从销售收入上看,PD-1/PD-L1药物的全球市场规模只用了3年时间就扩张到了超过100亿美元,增长极其迅猛。以PD-1为代表的肿瘤免疫疗法目前已经成为肿瘤临床治疗的核心治疗方案。
PD-1/PD-L1药物历年全球销售额(亿美元)
Opdivo
Opdivo最早于2014年7月在日本获得批准,是全球第一个获批上市的PD-1/PD-L1类药物。2014年12月,Opdivo获FDA批准上市,虽然比Keytruda晚了大约3个月,但是凭借前期在肺癌适应症上的优势,市场份额上一直领先Keytruda。
Keytruda
Keytruda由默沙东公司开发,是美国FDA批准的第一个PD-1免疫检测点抑制剂。2015年,美国前总统卡特晚期黑色素瘤在Keytruda的作用下,神奇消失;在今年结束的美国临床肿瘤学会(ASCO)年会上,Keytruda更是展现了治疗多种癌症的潜力。
Tecentrip
罗氏的Tecentrip(Atezolizumab)于2016年5月获批用于尿路上皮癌(膀胱癌),是全球第一个上市的PD-L1抑制剂。2016年10月被批准用于治疗靶向药、化疗失败的非小细胞肺癌患者。
Bavencio
2017年3,美国FDA宣告同意由德国默克公司与辉瑞一起研制的免疫疗法新药Bavencio上市,用于治疗梅克尔细胞癌(MMC,一种稀有肿瘤), Bavencio成为全球第四个PD-1/PD-L1抗体药物。

Imfinzi
2017年5月,PD-1/PD-L1抑制剂竞技场迎来了第五名玩家,阿斯利康PD-L1单抗Imfinzi 获得美国FDA加速批准,用于治疗晚期或转移性尿路上皮癌。

3国内PD-1竞争激烈
2018年6月15日,百时美施贵宝PD-1单抗药物Opdivo的中国上市申请正式获得CFDA批准。用于二线治疗非小细胞肺癌!目前提交上市申请的PD-1/PD-L1,另有4家申报上市:分别为君实生物的特瑞普利单抗(JS001)、信达生物的IBI308、恒瑞医药的camrelizumab以及默沙东的Keytruda。
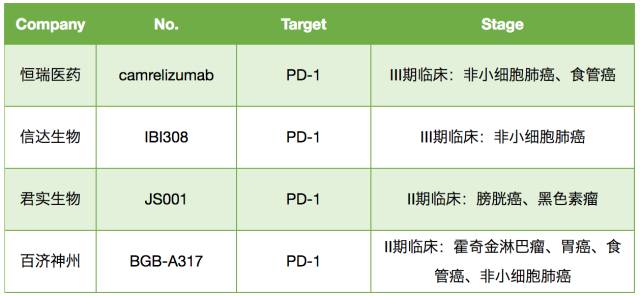
信达PD-1
2018年4月19日,信达生物重新提交的PD-1单抗信迪利单抗注射液的上市申请(CXSS1800008)正式获得药品审评中心承办受理。

另外,信达生物使用信迪利单抗的国内临床数据向FDA提交了美国新药临床研究申请(IND),已经获得FDA的临床许可,并且准许跃过I期临床直接进入美国II/III期临床研究。这标志着信迪利单抗在质量和安全性方面获得了美国FDA的初步认可。
君实PD-1
(1)医科院肿瘤医院I期临床:有效率40%
这项君实公司的PD-1抗体,I期临床试验,由中国医学科学院肿瘤医院,石远凯教授主持。分成3个剂量组: 1 mg/kg,3 mg/kg,10 mg/kg,入组了19名晚期实体瘤患者。
疗效方面:15位患者可评价,1位霍奇金淋巴瘤完全缓解,5位部分缓解(3位霍奇金淋巴瘤,1位软组织肉瘤,1位弥漫性大B细胞淋巴瘤),5 位病情稳定 (3位非小细胞肺癌, 2位头颈部鳞癌)——总体的有效率为40%,疾病控制率为73%。
副作用:绝大多数副作用为1-2级,包括:发热、腹泻、皮疹、流感样症状、乏力、黏膜炎、肝酶升高以及淋巴细胞减少等。1位患者出现了3级的肺炎,与药物的相关性不明确。
(2)北大肿瘤医院I期临床:有效率22%
另一项I期临床试验,由北京大学附属肿瘤医院,郭军教授负责,入组了22位黑素瘤、9位尿路上皮癌、5位肾癌患者,共计36名患者。
疗效方面: 36位患者治疗的中位时间为3.93个月,32位患者疗效可评价:1位黑素瘤完全缓解,6位患者部分缓解(3位黑素瘤,2位肾癌,1位尿路上皮癌),10位患者疾病稳定,15患者疾病进展——总体而言,有效率为22%、疾病控制率为53%,7位客观有效的患者中有1名患者依然在接受治疗。郭教授团队发现,那些PD-L1阳性的患者,有效率更高,达到了46%;那些肿瘤组织中存在淋巴细胞浸润的患者,有效率也更高,达到了50%。
副作用:绝大多数患者为轻度的不良反应,有3位患者出现了3-4级不良反应——1位是蛋白尿,2位是脂肪酶升高。
恒瑞PD-1
(1)国内的I期临床试验:有效率31.0%
由中国医学科学院肿瘤医院徐兵河教授主持,分成60mg 2周一次(12位患者)、200 mg 2周一次(34 位患者)、400 mg 2周一次(12 位患者)三组,未观察到严重的剂量限制性毒性。
入组的这58位患者,分别是如下这些肿瘤:29位食管鳞状细胞癌,8位胃癌,3位肺癌,3位鼻咽癌,3位肝癌, 3位结直肠癌,1位膀胱癌,另外8位患者病理类型未公布。
疗效方面: 总体有效率为31.0%,疾病控制率为46.5%,未见完全缓解的患者。18位患者达到部分缓解,包括: 10位食管癌、3位胃癌、1位肺癌,1位鼻咽癌、1位肝癌、1位结直肠癌、1位膀胱癌。
副作用方面:反应性毛细血管瘤(79.3%,绝大多数都是轻微的1级),甲状腺功能减退(29.3%),瘙痒(19.0%),转氨酶升高(13.8%),胆红素升高(12.1%),疲乏(12.1%),发热(10.3%),腹泻(10.3%)。一共4位患者发生严重的不良反应:1位慢性阻塞性肺疾病急性发作,1位心肌肌钙蛋白I升高,1位血小板减少,1位中性粒细胞减少。
(2)国外的I期临床试验:控制率43%
2015年9月,恒瑞公司以7.95亿美元的价格将自己的PD-1抗体在海外市场的开发和销售权益,出售给了Incyte公司。Inycte公司就在欧美等国开始了I期临床试验,试验的结果在上周的欧洲肿瘤学年会(ESMO)上正式公布。
这个临床试验分成两个部分,第一部分是剂量摸索:1mg/kg,3mg/kg,6mg/kg,10mg/kg,4周一次。第二部分采用的是固定剂量,600mg或者200mg,4周一次。
第一部分一共入组了23名患者,主要的副作用是:皮肤毛细血管瘤(61%)和腹泻(26%)。皮肤毛细血管瘤一般分布面部、上胸部,均为1-2级轻微反应,停药后可自行消退。1位患者出现了免疫性炎症反应。21位患者,疗效可评价,5位患者部分缓解,4位患者疾病稳定——有效率为24%、疾病控制率为43%。毛细血管瘤,是一种其他PD-1抗体都没有出现过的副作用,大多数都是轻微的、停药后可逐步消退。
经过第一部分的剂量摸索,第二部分选定的剂量是200mg或者600mg,4周一次,固定剂量,入组的病人也非常有趣:子宫内膜癌、胸腺癌、胆道系统肿瘤以及原发灶不明的肿瘤,一共入组了9名患者,有3名患者疾病稳定,疾病控制率为33%。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发