利用CRISPR基因编辑改善CAR-T疗法,科学家们怎么看?
| 导读 | 但它们在使用过程中均存在一定局限:必须采用病毒载体作为基因编辑系统的传导中介,对人源性的T细胞进行改造. 近日,来自帕克... |
2017年8月和10月相继在美国上市的Kymriah和Yescarta是CAR-T细胞治疗领域颇具代表性的两款产品。但它们在使用过程中均存在一定局限:必须采用病毒载体作为基因编辑系统的传导中介,对人源性的T细胞进行改造。
近日,来自帕克癌症免疫疗法研究所的科学家声称他们采用CRISPR基因编辑技术,完善的一种新方法将改变CAR-T疗法现有技术——为CAR-T细胞的构建和工业化生产都开启了新的大门,且比第一代CAR-T疗法的开发更容易。
此前已经有媒体报道,帕克癌症免疫疗法研究所的阵营非常豪华,科学家们大多来自于美国加州大学旧金山分校(UCSF)或是洛杉矶分校(UCLA),且均具有肿瘤免疫的研究背景。这篇于7月11日发表在的《Nature》杂志上的研究团队同样都是来自于UCSF或UCLA。
基于新一代基因编辑技术CRISPR辅助CAR-T疗法的开发,大咖们是如何看待的呢?Endpoints主编John Carroll也采访了多位与该技术开发相关的一线研究人员,以下是对他们的观点综合。
基因编辑技术CRISPR并不是什么新鲜事。理解起来也比较容易,就是一种基因编辑技术,能比较精准对生物的DNA序列进行修剪、切断、替换或添加,在一些学术实验室和相当多的商业实验室风靡一时。

Antoni Ribas
加州大学洛杉矶分校研究员Antoni Ribas在业内颇具名气,并参与了该项目。他表示团队阐明的这项技术,或将替代病毒载体,后者常常供应短缺。
据了解,在此前的CAR-T细胞制备过程中,病毒载体的包被和测试需要较长时间,并且其导入过程是非定向的,遇到编辑过长的基因片段时甚至会杀死T细胞,同时在病毒宝贝过程中需要耗费大量的人工成本。
新方法意味着,将使得对T细胞的编辑更快(faster)、更好(better)、更便宜(cheaper)。

Fred Ramsdell
帕克癌症免疫疗法研究所的另一位科学家Fred Ramsdell对此点评道,“在过去,制备出合适的CAR-T细胞可能需要几个月甚至一年的时间,而现在则仅需要数周的时间。对于癌症患者而言,几周与几个月的时间,很有可能会使肿瘤细胞发展产生巨大的差异。”
同样,对于开发CAR-T细胞疗法的企业而言,更快的速度意味着更高的效率,提前占领市场的可能性也更大。

Alex Marson
UCSF微生物学和免疫学副教授Alex Marson补充道,CRISPR通过切割和中断有效地敲除了基因。“你可以一次更换几个核苷酸,”他指出,“但是如果你输入更大的数据,就会杀死细胞。”
通过查阅科研文献发现,新的方法运用了基因同源修复技术取代了原有的简单粗暴的基因敲除模式,从而实现了插入基因的无缝对接,在最大化降低对原有基因损伤的同时还起到了精确定位的作用(如图1)。
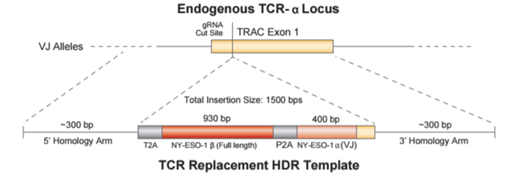
图1:TCR技术中的同源修复策略,实现了插入位点和插入片段的精准化(上方是改造前的基因序列,下方是改造后的基因片段)
同时团队利用具有Cas9蛋白表达的RNA复合物(RNP)和具有同源片段的双链DNA模板取代了原有DNA环形质粒,这无疑降低了原有的高浓度DNA质粒对T细胞造成的毒性损伤。更为重要的是,新技术采用了电穿孔转染的技术代替了原有的病毒导入,既简化了工艺流程又降低的生产成本(图2)。
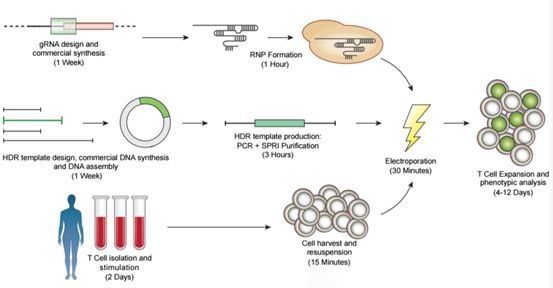
图2:新技术的工艺流程
“这对于改变T细胞的工作方式来说是一种灵活的方式,”Marson补充道,“团队已经在实验室中进行体外研究罕见和严重的小儿自身免疫疾病,还有一个项目是开发治疗黑色素瘤的CAR-T疗法,目前该方法已经成功地在小鼠中进行测试。”
现在焦点将转移到人体试验中。Marson坦言,他们团队正就这项技术的转化应用,与潜在的商业合作伙伴及FDA进行了交流,以探索该技术在临床上的应用步骤。

Theo Roth
据加州大学旧金山分校的在校生、也是这篇文章的的主要作者Theo Roth透露,将新基因导入T细胞这一过程,人类已经尝试了30多年。幸运的是,现在实验室不再需要6到7个人使用病毒来设计T细胞。当下,全球已经有数百个实验室在设计这些细胞,并且将工作越来越多地聚焦在复杂的DNA序列,并努力去尝试更多的可能性,这显然将加速未来几代细胞疗法的发展。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发