Nature发表T细胞基因编辑新方法
| 导读 | 近期,Nature杂志发表出一项具有重大突破的研究,即无需病毒载体,采用电穿孔成功对人T细胞进行CRISPR基因编辑,可加速开发新的更加安全的治疗癌症、自身免疫性疾病以及其它罕见的遗传性疾病的疗法 |

近期,Nature杂志发表出一项具有重大突破的研究,即无需病毒载体,采用电穿孔成功对人T细胞进行CRISPR基因编辑,可加速开发新的更加安全的治疗癌症、自身免疫性疾病以及其它罕见的遗传性疾病的疗法。此消息被药明康德、基因治疗领域等公众微信号相继报道,并且取得了很高的阅读量。由此可见,大家对于更安全、更便宜、更快、更精确的T细胞基因编辑以用于疾病的细胞治疗可谓是翘首跂踵。
目前市面上的CAR-T制备,主要还是基于病毒载体,包括目前获批上市的CAR-T疗法,都是基于病毒载体的编辑技术。病毒载体本身成本高、周期长、无法有目的性地将目的基因精准插入到基因组某一位点,并且最重要的是有可能会对病患带来潜在的风险,比如影响健康基因的表达,或导致插入基因异常调节,出现失控等。因此,FDA强烈要求要对接受过病毒式转导T细胞的患者进行15年的随访。病毒载体的这些缺陷大家有目共睹,之所以此方法还在使用,一方面是基于病毒载体疗法的研究确实取得了诸多突破和进展,另一方面,研究者的确尚未建立成熟的不依赖于病毒载体的其它更加安全的基因编辑方法。事实上,已经有相当多的研究人员正在开发尝试基于电穿孔的基因编辑技术,而Nature发表的这项新成就的第一作者Theo Roth及其团队成功做到了电穿孔方法实现T细胞基因编辑,对整个细胞治疗领域带来革命性的变化,可谓使免疫治疗步入了下一代。
电穿孔技术是指给细胞施加一定的电脉冲,在细胞膜上瞬时穿孔,允许外源性的DNA、RNA或小分子药等进入细胞内。但是以往研究发现,当加入长的双链DNA以及浓度非常高的情况下,会对细胞造成很高的毒性引发细胞死亡,短的单链DNA就不会。这也是限制电穿孔方法进行T细胞基因编辑的瓶颈。Theo及其团队打破了这个瓶颈,他们使用CRISPR-Cas9系统和双链DNA模板共转染的方式,按照一定的比例共同加入到转染体系中,很好的解决了双链DNA对细胞毒性大的问题。CRISPR与DNA的比例、细胞培养的不同方式、不同强度的电脉冲等这些参数都需要摸索优化。Theo及其团队非常明智地选择了Lonza的96 shuttle高通量的电穿孔系统进行数千种实验条件的摸索和尝试。
Lonza 96 shuttle电穿孔系统可以一次性转染96个样本,可设置96种不同的转染条件,大大降低了实验条件优化的工作量。转染体系只有20μl,节约细胞和底物的用量。可以对接实验室液体处理工作站实现自动化地移液分液,大大提高了工作效率。将原来需要数月甚至数年的工作大大缩短至几周!
利用该CRISPR基因编辑系统,研究人员可以“随心所欲”地将GFP表达于细胞的不同部位。并且这种操作高度特异,脱靶几率相当低。(图1)
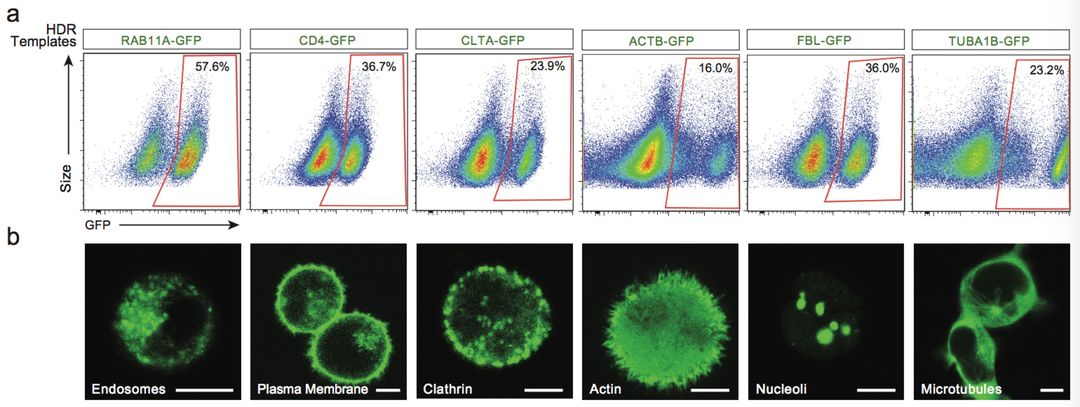
图1 按照设计,GFP特定表达在胞核、胞膜、胞骨架以及细胞器。
第一作者Theo、通讯作者Marson及其团队使用该项新技术证明了在对抗自身免疫性疾病以及治疗癌症方向的临床应用潜力。主要是基于两方面:校正单基因自身免疫性疾病患者的T细胞IL2RA基因突变,增强其信号转导功能;另一方面用新的TCR替代原有的TCR位点,使T细胞更好地识别肿瘤抗原并杀伤。
Theo等从罹患罕见自身免疫性疾病的儿童患者中获得T细胞,测序结果显示这些T细胞的IL2RA基因带有突变,使其无法正常行使功能。调节性T细胞发育异常,免疫系统无法得到有效控制,从而产生了自我攻击反应。利用非病毒CRISPR技术成功修复了患者T细胞IL2RA基因突变缺陷。(图2)
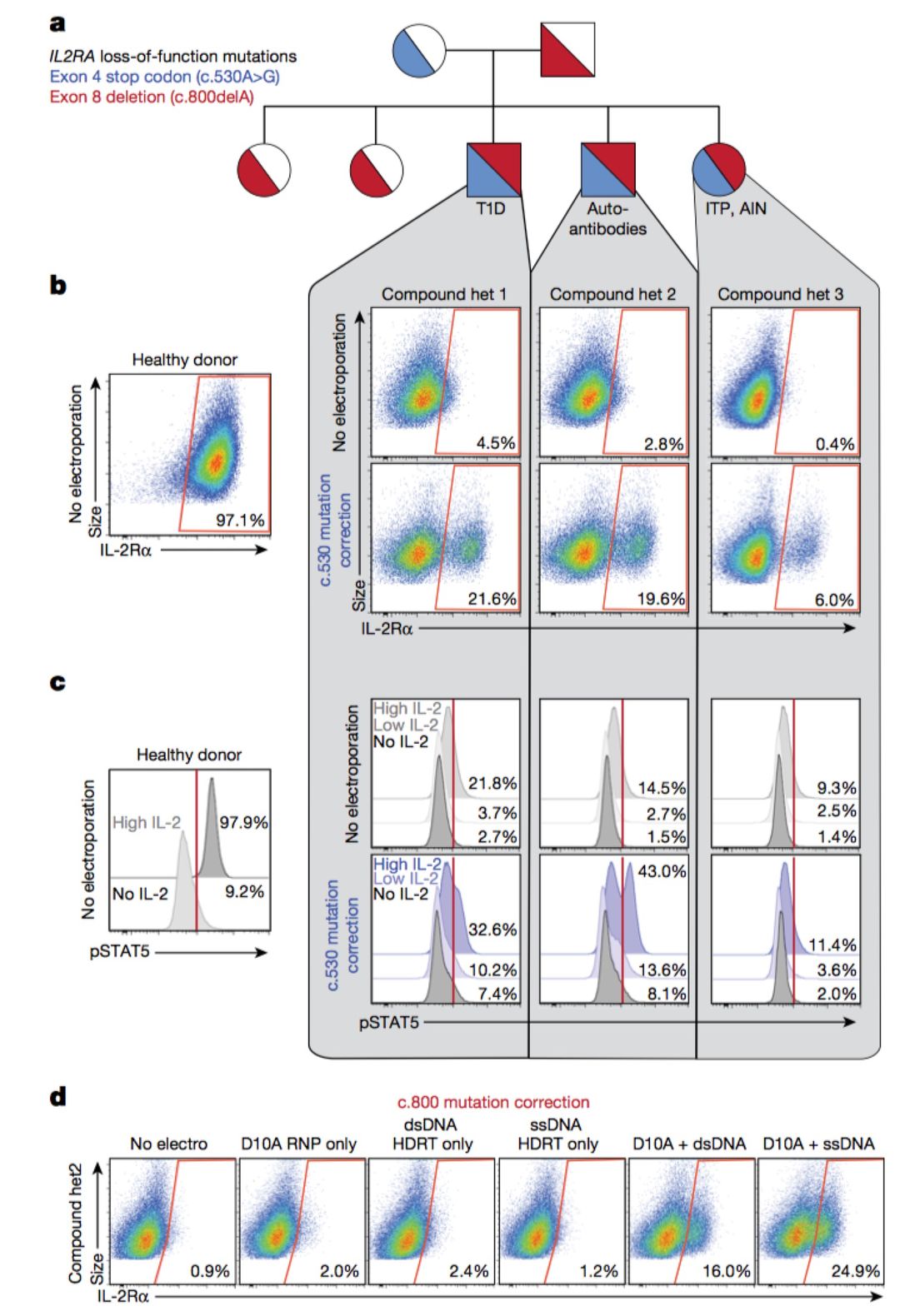
图2 利用非病毒CRISPR技术修复T细胞IL2RA突变缺陷
a:单基因自身免疫性疾病家谱图;b:非病毒CRISPR技术校正c.530A>G IL2RA突变,校正后的IL-2Rα表达升高;c:非病毒CRISPR技术校正后的T细胞,IL-2刺激后,STAT5磷酸化水平增强;d:使用D10A剪切酶和长单链DNA HDR模板校正c.800delA突变,IL-2Rα表达升高。
Theo等从健康人体内获得T细胞,利用Lonza Nucleofection电穿孔技术更换了T细胞的TCR,使这些细胞能够特异性地攻击人黑色素瘤细胞。体外细胞培养实验表明,经改造后的T细胞能有效地靶向黑色素瘤细胞,而不会识别其它类型的细胞,表明了其特异性。小鼠肿瘤模型实验也证明改造后的T细胞能特异聚集在肿瘤位点,表现出抗癌活性。(图3)

图3 改造的T细胞特异性聚集在肿瘤附近,与病毒载体改造的细胞有类似的肿瘤杀伤效率
目前该团队正在与美国FDA讨论如何使用新方法攻击实体瘤及血液肿瘤,我们期待这项突破性的技术能转化到临床,为全球患者带来福音。
Lonza Nucleofector电穿孔技术最早开发优化的细胞即人T细胞,目前已经非常成熟,有大量的用户和文献表明可成功转染T细胞,实现理想的转染效率和细胞活性。基因有限公司是Lonza Nucleofector核转染系统的全国代理商,提供从20μl、100μl小体系到LV 20ml大体系的转染,为细胞治疗提供从前期研发到临床生产的全套方案。
基于该电穿孔的T细胞改造体系和过程,非常容易符合GMP标准以应用于临床,有利于加快研发到临床的快速转化。(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发