上海交大团队在基因编辑机制方面取得颠覆性突破
| 导读 | 近日,上海交通大学系统生物医学研究院比较生物医学研究中心吴强教授课题组在国际著名期刊Molecular Cell《分子细胞》上在线发表了题为“Precise and Predictable CRISPR Chromosomal Rearrangements Reveal Principles of Cas9-mediated Nucleotide Insertion《精准且可预测的CRISPR染色体重排揭示Cas9介导的碱基插入规律》”的最新研究成果,在基因编辑机制方面取得了原始创新性进展,颠覆了已有的基因编辑认识。揭示了CRISPR/Cas9新一代基因编辑系统全新的切割机理及其在染色体重排和DNA修复中的作用,实现了精准的DNA大片段编辑及可预测的碱基插入。 |
近日,上海交通大学系统生物医学研究院比较生物医学研究中心吴强教授课题组在国际著名期刊Molecular Cell《分子细胞》上在线发表了题为“Precise and Predictable CRISPR Chromosomal Rearrangements Reveal Principles of Cas9-mediated Nucleotide Insertion《精准且可预测的CRISPR染色体重排揭示Cas9介导的碱基插入规律》”的最新研究成果,在基因编辑机制方面取得了原始创新性进展,颠覆了已有的基因编辑认识。揭示了CRISPR/Cas9新一代基因编辑系统全新的切割机理及其在染色体重排和DNA修复中的作用,实现了精准的DNA大片段编辑及可预测的碱基插入。

CRISPR/Cas9系统是近年国际上兴起的新一代基因编辑技术。这一划时代技术虽然起源于细菌和古生菌,但在真菌及高等动物植物基因组改造中,以及农业科学、生命医学、新药创制等“卡脖子”领域已得到了迅速而广泛的应用。近年来,借助我国物种多样性这一优势,国内基因编辑研究工作获得了空前的发展,取得了一系列重要进展,在多个物种的基因编辑技术领域实现了国际“并跑”到“领跑”的转变。国际上的基因编辑应用研究如火如荼,但对Cas9核酸酶的切割原理和修复机制研究还比较少。
从基因打靶技术在2007年获得诺贝尔奖后,2012年开始发展起来的CRISPR/Cas9基因编辑技术是最具潜力获得诺贝尔奖的。自从这一新一代基因编辑系统建立以来,人们普遍认为Cas9核酸酶切割DNA双链是产生平头末端的。特别是早在2012年,CRISPR/Cas9研究的先驱杜德娜(Doudna)和夏庞蒂埃(Charpentier)发表在Science的研究论文,以及Siksnys发表在PNAS的研究论文,发现Cas9切割DNA产生平头末端,前者进一步报道体外断裂实验所观察到的现象是由于Cas9核酸酶的核酸外切活性所导致的,Cas9具有核酸外切酶活性。
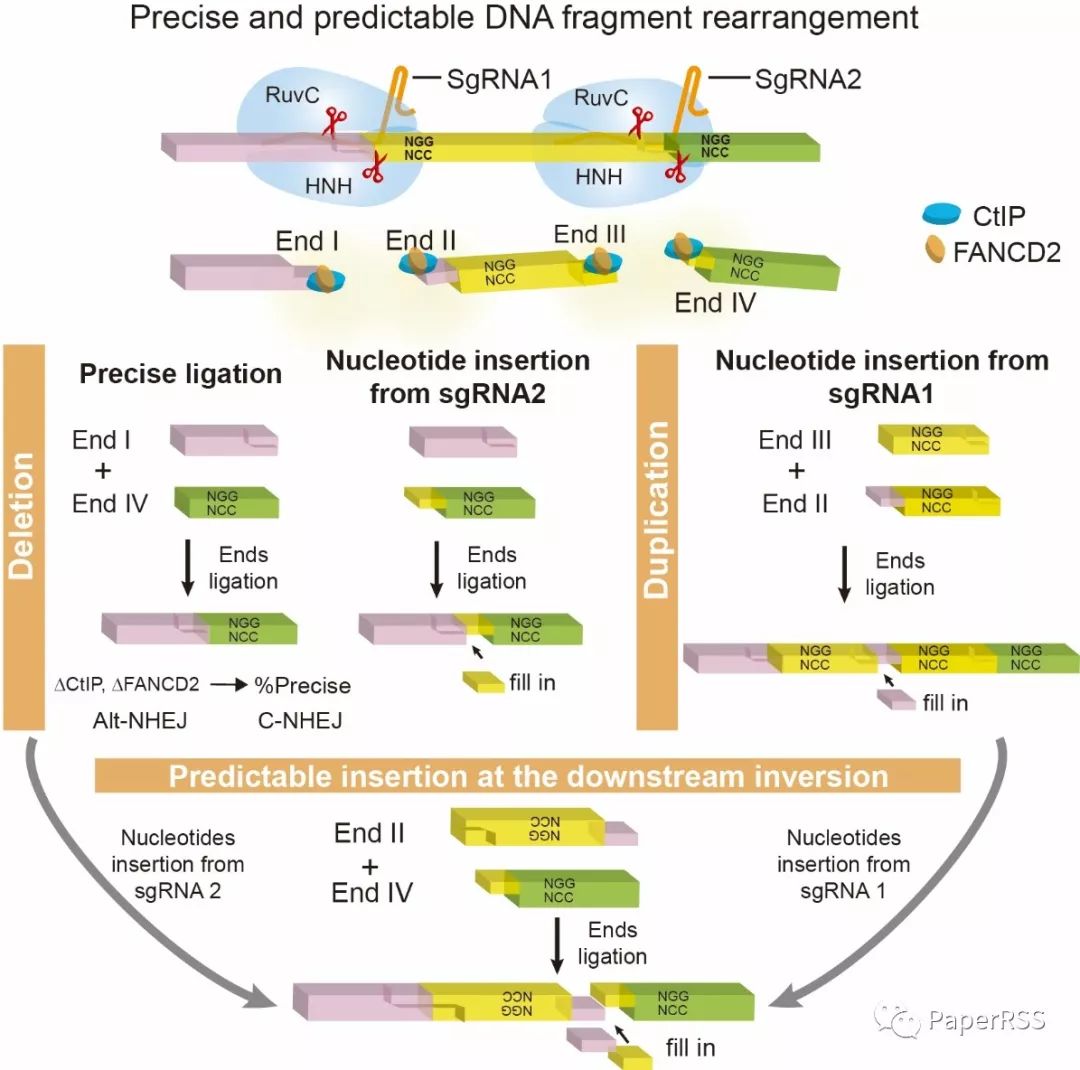
上海交大吴强团队通过开发DNA片段编辑技术,结合高通量测序技术及蛋白质工程技术,发现Cas9核酸酶通过核酸内切酶活性切割DNA双链能够产生突出末端,而不仅仅是之前报道的平头末端切割方式,Cas9不具有核酸外切酶活性,而仅具有核酸内切酶活性。同时发现通过基因工程改造后的Cas9核酸酶具有不同的突出末端切割模式,从Cas9核酸酶的结构上更进一步证明了Cas9切割的多样性。综上所述,该研究从根本上颠覆了人们对Cas9核酸酶切割DNA的既有认识,可能成为CRISPR/Cas9新一代基因编辑系统基础研究具有转折意义的发现和原始创新,为优化和改造基因编辑技术奠定了坚实基础。
肿瘤疾病是目前困扰人类的最大难题之一,肿瘤的发生发展是多因素、多阶段、多基因且与环境共同作用的结果。染色体重排在肿瘤发生发展中至关重要,例如治疗白血病的“神药”格列卫的原始靶点就是由染色体重排产生的。染色体重排包括染色体的大片段缺失、反转、重复和易位等,通常与恶性肿瘤密切相关。当三维基因组染色体结构变异发生在基因的编码区时,会造成基因的异位或非正常表达,或引起基因拷贝数的变化,从而影响基因调控和基因功能。当染色体结构变异发生在基因的非编码区时,也会通过长距离染色质环化的改变,进一步影响三维基因组染色质高级结构异常,从而造成基因调控与基因功能的改变。最近新兴的基因编辑和DNA片段编辑技术为三维基因组染色体异常等相关疾病的根本病因的研究和最终治疗手段提供了重要技术支持。尤其是利用CRISPR基因编辑技术构建特定的三维基因组染色体结构变异疾病模型,能够极大的促进对恶性肿瘤的发生机制及治疗手段的研究,同时理解染色体异常的DNA损伤修复机制也能为潜在的肿瘤治疗手段提供支持。
吴强团队长期致力于利用基因打靶和基因编辑技术研究基因组DNA大片段敲除或编辑。早在2015年,课题组博士生李金环和寿佳合作发表了关于DNA片段编辑的研究工作,阐述了利用CRISPR双切点的DNA片段编辑机制,开发了基因组DNA大片段编辑技术,包括反转基因调控元件、敲除基因簇、重复DNA片段等。这种技术方法比传统的通过同源重组获得的DNA片段重排方法更为高效,为研究三维基因组大量未知元件的调控机制以及癌细胞染色质高级结构的变异提供了便利手段。同年,该团队利用这一DNA片段遗传编辑技术对基因组特定遗传元件进行反转,结合计算生物学,发现了CTCF位点和方向在三维基因组染色质高级结构折叠的重要规律,相关研究结果发表在Cell杂志上。课题组利用基因编辑技术研究原钙粘蛋白脑发育功能也获得了重要进展,于2018年6月份发表于eLife杂志上。
该研究在前期工作积累的基础上,在Cas9核酸酶的切割原理及细胞的DNA损伤修复机制方面取得了原始创新,颠覆了该研究领域的原有认知。CRISPR基因编辑工具利用Cas9核酸酶结合靶标特异性RNA分子对基因组DNA特定区段进行靶向切割,从而产生双链断裂,随后在细胞内非同源末端连接修复通路的作用下(普遍认为细胞的同源修复通路是精准的,而非同源末端连接修复通路是随机的),对DNA断裂末端进行修复,从而造成随机插入删除。该研究通过敲除或干扰在癌症中起到关键作用的DNA修复蛋白,能够显著提高精准的DNA片段编辑效率,同时证明细胞内非同源末端连接修复通路也是一种精准的DNA修复方式。
此外,该研究利用高通量测序技术对DNA片段编辑的双链断裂末端进行分析发现,断裂末端的核苷酸加入呈现非常有规律的模式。通过一对导向RNA分子的四种不同切割构型,结合测序技术和基因工程技术,证明Cas9介导的碱基插入在DNA片段编辑中是能够预测的。这一可预测的染色体重排规律,为研究人类染色体异常引起肿瘤等相关疾病提供技术支持,进而推动相关领域的发展。
该研究获得了评审专家的高度肯定:“该工作很有趣很有意思,该研究对于预测Cas9介导的DNA片段编辑结果很有帮助”;“DNA大片段编辑的选题以及对DNA修复的意义很有相关性,很有意义,实验数据尤其引人注目,该研究很可能在基因编辑以及构建染色质重排的多种疾病模型领域引发广泛的兴趣”;“该研究为可预测的DNA片段编辑提供了崭新证据,实验设计好,实验结果质量高,Cas9核酸内切酶活性切割DNA形成突出末端是一项非常意外的发现,也是一项重大发现。”
总之,该研究首次开发了通过调控细胞修复系统实现精准的DNA片段编辑方法,以及通过研究DNA片段编辑接头处的特定碱基加入,从而实现了可预测的DNA片段编辑。这项研究为进一步理解DNA双链断裂修复机制,以及三维基因组DNA片段的编辑应用奠定了重要基础。在基因组编辑工具CRISPR技术飞速发展的今天,该研究系统的阐述了如何利用细胞内修复蛋白介导精准的DNA片段编辑,有望推动三维基因组染色体异常等遗传疾病的相关研究。
该研究由上海交通大学独立完成,吴强为通讯作者,交大博士生寿佳和博士后李金环为共同第一作者。该研究得到国家自然科学基金委员会和科技部的资助。
论文链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(18)30466-0(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发