FDA局长最新讲话:临床试验改革势在必行!
| 导读 | 近日,美国FDA局长ScottGottlieb博士在一次口头报告中,介绍了FDA在落实《21世纪治愈法案》中所取得的进展。 |
近日,美国FDA局长Scott Gottlieb博士在一次口头报告中,介绍了FDA在落实《21世纪治愈法案》中所取得的进展。其中,Gottlieb博士指出,目前在临床试验上的限制,影响了新药获批上市、来到患者面前的速度。为此,FDA也将继续对临床试验进行改革,让更多患者更快用上安全有效的创新疗法。

▲FDA局长Scott Gottlieb博士近日发表了关于临床试验改革的讲话(图片来源:FDA官网)
Second-in-class在哪里?
新药从研发到上市是一条漫长的道路,其中很长的一段旅程是临床试验。为了确认新药分子的安全性与有效性,临床试验是不可或缺的。但临床试验的成本与复杂度,也可能为新药上市带来阻碍,延长新药研发的周期。
这正是FDA主导的一项研究所发现的结果。在该研究中,人们分析了由CDER批准的同类疗法的数目。同类疗法是指具有同样作用机制,对相同或相关疾病进行治疗的疗法。分析结果则表明,近年来,同类疗法的上市速度有着明显的放缓。
本文来源:药明康德
对于非孤儿药(治疗广大的患者群体)来说,在1991年到2000年这10年里获批的“first-in-class”新药中,有41%的新药在短短5年里,就迎来了“second-in-class”的同类药物,这也让患者们迎来了更多的治疗选择。然而在2001年到2010年这10年里,这一比例有着明显下降——只有18%的“first-in-class”新药在5年里迎来了同类疗法。
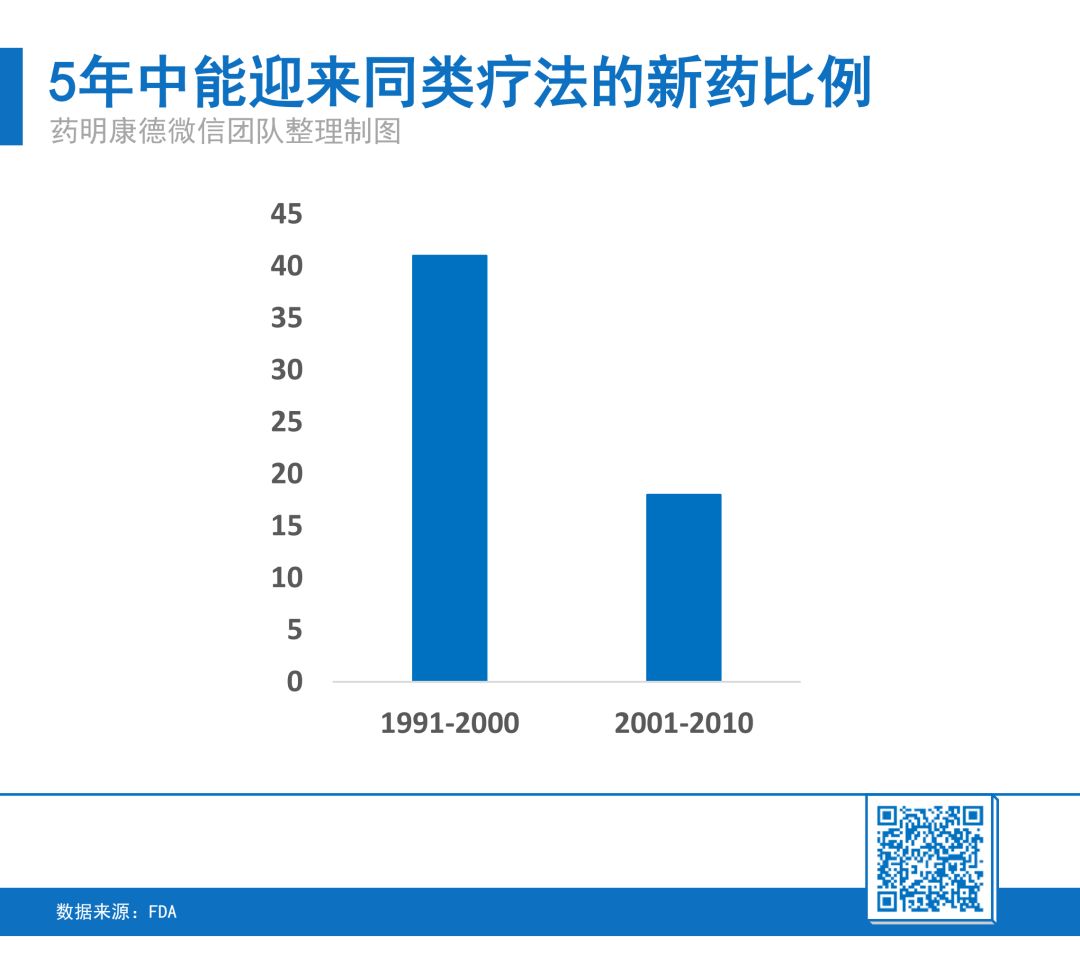
从另一个维度看,在1991年到2000年期间,仅仅需要2年,就有四分之一的“first-in-class”新药迎来了同类疗法。而在2001年到2010年期间,患者需要等待的时间要超过7年。
在孤儿药领域,这个现象同样存在。与1991年到2000年期间相比,在2001年到2010年期间,只有13%的“first-in-class”孤儿药能够在5年里迎来另一款同类疗法,幅度仅为之前的50%。
“现有‘一款新药,一项临床试验’的效率不高,可能带来(资源的)浪费,” Gottlieb博士说道:“它不但会延误创新疗法的上市,还会延缓对这些疗法表现的充分评估。”
临床试验改革
Gottlieb博士在报告中指出,同类疗法之所以上市缓慢,部分原因在于其临床试验设计的困难。对于那些有未竟治疗需求的疾病,一旦有疗法问世,第二款疗法的上市就会变得困难。“这是一个问题”,Gottlieb博士说。而解决之道,或许就是对临床试验进行“现代化改革”。
“高效而现代的临床试验设计与进行,能解决部分挑战,” Gottlieb博士补充道:“这些方法能让我们高效了解更多新药的安全性与收益。如果你所做的是现代、循证、严格的事,就能确保极大的高效,并对FDA金标准带来极大保障。”
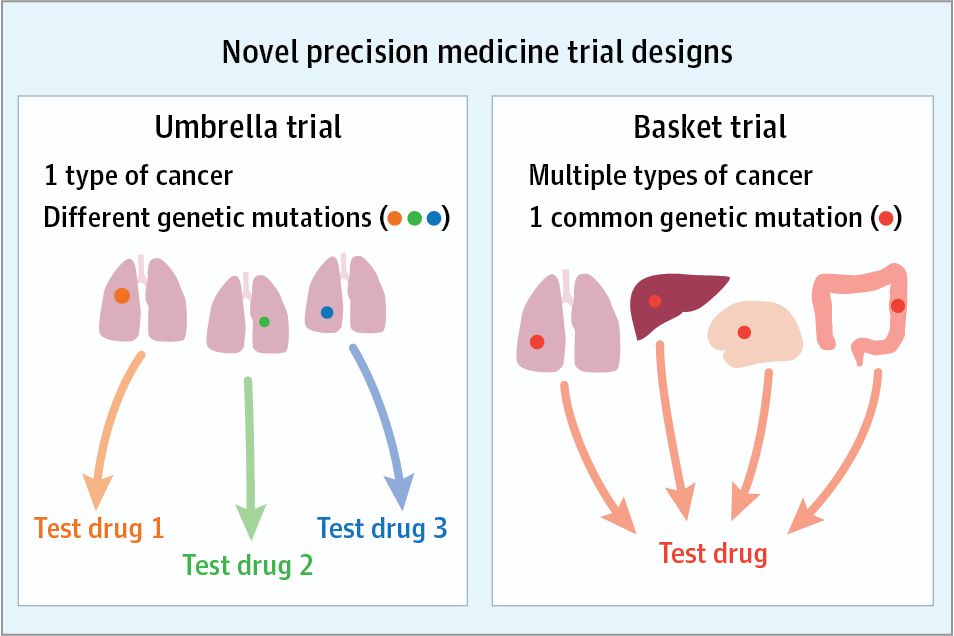
▲雨伞试验与篮子试验示意图(图片来源:《JAMA Oncology》)
FDA拟启动的第一项举措,是名为“Master Clinical Trial Protocols”的方法,它囊括了篮子试验、雨伞试验、以及平台试验。Gottlieb博士认为“这些方法能极大提高临床试验的效率,并降低成本”。它们有望打破“一款新药,一项临床试验”的常规,通过对临床试验框架的普及,基于生物标志物,在一类或多类疾病中测试多种新药。过去,此类方法在肿瘤学领域得到了初步的尝试与应用。如今,它们有望在更多疾病领域中得到应用。
而另一项举措则是无缝的临床设计,它能将传统的三大临床阶段进行压缩,合并成一个连续的临床试验。这有望让研究人员在招募新的患者时,通过已知信息预测患者的疗效,将他们分配到相应的队列中。由于临床试验的主要时间成本与金钱成本主要耗费在每个临床试验阶段的结束与开启之间,新的“连续临床试验”框架有望降低成本,提高效率。
新型指导方针
为了让研发新药的公司更好地理解这些新策略,美国FDA即将公布一系列指南,介绍如何开展无缝的临床试验,如何随着试验进展拓展队列,以及拓展这些队列的临床标准。
具体来说,新的指南将对first-in-human的临床试验进行指导,协助开设多个可拓展的队列,加速新药临床试验的进程。这些临床试验需要通过生物标志物对患者进行选择,并能基于科学方法,告诉我们哪些中期临床终点或替代终点可能与长期临床效果有关,从而更为便捷地找到药物的积极作用。
Gottlieb博士认为,通过应用这些方法,每一个队列都能用来回答关于新药安全性与疗效的特定问题。总体看来,我们会提出更多的问题,也会收获更多的答案。
而对于那些已经获得突破性疗法认定的新药来说,对于临床试验队列的扩增,则能通过筛选1期临床试验阶段发现的生物标志物,扩大招募的范围,以在无缝、连续的临床试验中对新药展开评估。
同时进展的多个独立队列,能让我们在单项大型临床试验中获得大量有用的信息,了解新药的安全性、新药在人体内吸收与分布有关的药代动力学、以及新药的抗肿瘤活性。只要为这些不同的重要问题设立单独的队列,它们就有望得到评估与解答。“通过无缝的试验设计,新药开发会变得更有效率,” Gottlieb博士说道:“整个试验流程仅需要几百名患者就能完成。”
替代终点
在发言中,Gottlieb博士花了很大的篇幅介绍替代终点。这对于那些需要很久才能获得结果的临床试验,或是对于那些我们已有足够了解的临床试验(比如控制血压,或者降低HIV病毒量)而言,是一个很好的选择。
事实上,在癌症领域,替代终点已经得到了许多人的认可,并成为了许多常规获批,甚至是加速获批所考量的对象。譬如对于急性淋巴性白血病来说,最小病灶疾病缓解率(minimal residual disease response rate)是其疗法加速获批的替代终点;而对未扩散的去势抵抗性前列腺癌来说,无转移生存期(metastasis-free survival)也是获批所审查的一个临床终点。
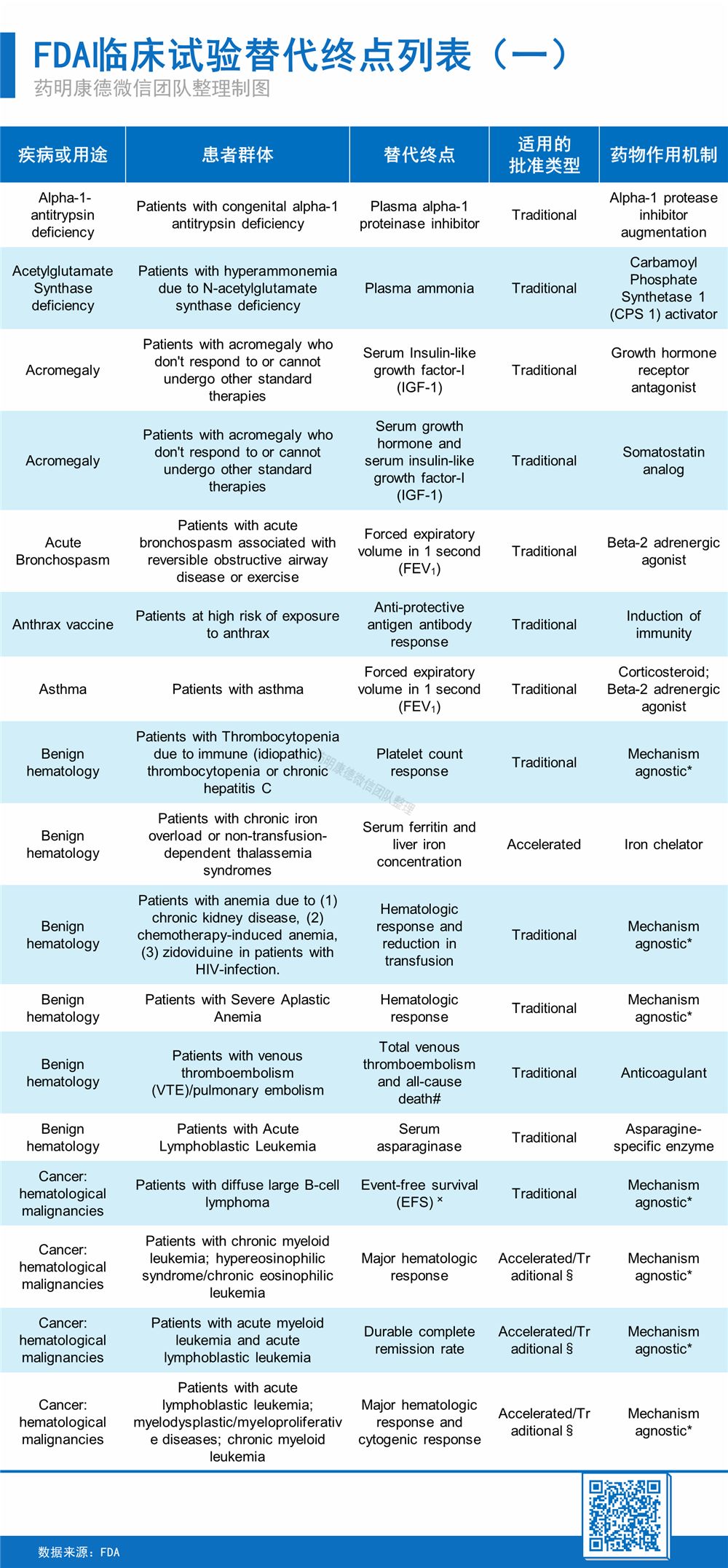
▲关注药明康德微信号,在后台回复“替代终点”,即可获取完整替代终点列表(共七页)
“在癌症领域使用替代终点,能将充满潜力的疗法送到高风险的患者身边。与过去的临床终点相比,替代终点能将进程加快好几年,”Gottlieb博士说道:“在某些案例中,它还能增加抵达长期缓解的几率。”
美国FDA也为我们提供了一张完整的替代终点列表。它将是诸多化学药或生物制剂获批的基础。关注药明康德微信号,在后台回复“替代终点”,即可获取完整替代终点列表。
15年来的突破
在这份口头报告的最后,Gottlieb博士讲述了自他加入美国FDA的15年来,人类在疾病治疗领域取得的巨大进展。他说:
“当我在2003年首度加入FDA之际,HER2阳性的转移性乳腺癌是最为可怕的癌症诊断。那时,肿瘤免疫疗法找不到出路,基因疗法处于停摆,基因编辑更是无从说起。”
“患有顽固性白血病和淋巴瘤的患者,只能悲剧性地用月来计算自己的生命。患有丙肝的患者还在使用利巴韦林和干扰素这些毒性较强,耐受很差的药物。对于这些患者,我们很少能带来治愈。”
“儿童2型糖尿病患者的父母,每天晚上隔几个小时,就要叫醒自己的孩子,测量他们的血糖水平,决定要不要使用胰岛素。我们还没有数字医疗的概念,智能手机、app库都还不存在,用于医学的人工智能还处于萌芽。”
“仅仅是15年,一切发生了如此大的不同!”
▲药明康德独家深度报告:免疫疗法能消灭癌症吗?(图片来源:123RF)
“免疫检查点抑制剂正为一些转移性黑色素瘤和肺癌患者带来前所未有的治疗结果;丙肝的治愈率达到了95%以上,疗法不但更有效,毒性还更小;经过基因编辑的T细胞在至多60%的患者中展现出了持久的缓解疗效,要知道,这些患者得的都是对药物产生耐受的致命白血病和淋巴瘤;慢性淋巴性白血病和慢性骨髓性白血病能被当作慢性疾病来进行控制和管理;许多血液癌症患者的病情已经稳定了数年,甚至是数十年。”
“在HER2阳性的转移性乳腺癌治疗中,许多新线疗法获批。通过采取全新的临床终点,辅以手术,我们为这些患者拓展了有效的治疗选择,降低了她们疾病复发的风险。1型糖尿病患者也已经有了FDA批准的闭环胰岛素递送系统,它能通过算法,基于每5分钟一次的实时数据监控,递送基础水平的胰岛素,从而减少,甚至彻底消除由于血糖监测带来的睡眠干扰。”
Gottlieb博士总结说,这正是对临床试验进行现代化改革的动力。为了让患者尽快得到治疗,这样的改革势在必行!
我们期待随着对临床试验的一系列改革,不但更多first-in-class的新药能加快问世,更多second-in-class的新药也能尽快来到患者身边,给他们带来安全有效的创新疗法,改善他们的健康!
参考资料:
[1] Implementing the 21st Century Cures Act: An Update from FDA and NIH - Oral Statement
[2] FDA官方网站(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发