晚期NSCLC,多基因测序能否带来生存获益?
| 导读 | 近年来,随着基因组学的研究进展,晚期NSCLC患者中,越来越多的驱动基因被发现。那么,广谱的基因检测对比常规的基因检测(EGFR突变和ALK重排),是否能给患者带来生存获益呢?近日,发表在JAMA的一项研究回顾性分析了在美国社区癌症中心接受诊疗的晚期NSCLC患者,广谱的基因检测对比常规的基因检测患者的生存差异。 |
背景
针对晚期NSCLC患者EGFR突变和ALK重排的靶向治疗相比于化疗,可以显著改善患者的OS。因此,对于晚期NSCLC患者,应该常规检测EGFR突变和ALK重排。广谱基因测序不同于EGFR/ALK检测,采用NGS可以同时检测30至上百个基因。目前,NCCN指南推荐对患者进行广谱基因测序,以发现少见驱动突变,并寻求参加其他靶向治疗的可能性。然而,目前关于广谱基因测序也存在争议,主要是因为临床可靶向的突变较少,患者接受检测后生存能否改善,以及治疗花费。
在社区医院接受治疗的大量晚期NSCLC,采用广谱基因测序能否改善患者的OS,目前尚未明确。唯一的一项随机临床试验,采用试验性的广谱基因测序(SHIVA研究)并没有发现其可以改善患者的PFS。与之类似,一项由肺癌突变联盟进行的前瞻性研究,在14个学术中心采用可以同时检测10个癌症驱动基因的多基因检测,结果显示,49例接受除EGFR/ALK TKI之外的靶向治疗的患者,并未显示出显著获益的OS,然而这一研究中检测的基因数目较少。另一项回顾性研究对比了进行广谱基因测序后接受靶向治疗的患者和未接受靶向治疗的患者,观察到靶向治疗组的OS获益,但本研究并没有排除EGFR突变和ALK重排的患者。
为了更好的明确广谱基因测序优于常规EGFR/ALK检测,研究者在社区肿瘤中心中对比了接受广谱基因测序和接受常规EGFR/ALK检测的晚期NSCLC队列,比较两组患者的生存差异。
方法
这是一项回顾性队列研究,采用Flatiron健康数据库来筛选诊断为IIIB/IV其或复发性非鳞晚期NSCLC患者,接受广谱基因测序或常规基因检测(EGFR/ALK检测)并接受一线抗肿瘤治疗。广谱基因测序包括任何的多基因检测panel,覆盖30多个基因。主要研究终点为从接受一线治疗开始的12个月的病死率。在倾向性评分匹配生存分析中,主要研究终点为OS,定义为开始一线治疗至死亡或最后随访时间。最后随访时间为2016年7月31日。次要研究终点为特定基因变异的发生率和患者接受的治疗。
结果
基线特征
研究入组了5688例接受广谱基因测序或常规基因检测的晚期NSCLC患者,其中875(15.4%)例患者接受广谱基因测序,见表1. 患者的中位年龄为67岁,大多数患者为白人,多数患者有吸烟史(79.9%)。根据既定的纳入标本,所有患者均接受了EGFR突变检测,仅95%的患者接受了ALK检测。在接受广谱基因测序的患者中,多数患者接受了ROS1,KRAS和PD-L1检测。在多因素分析中,接受广谱基因测序的患者,更有可能接受免疫治疗,OR 2.48 [95% CI,2.0-3.0],P < 0.001,在前4线治疗中接受免疫治疗的患者,有显著更长的OS,HR 0.41[95% CI, 0.36-0.47],P < 0.001。
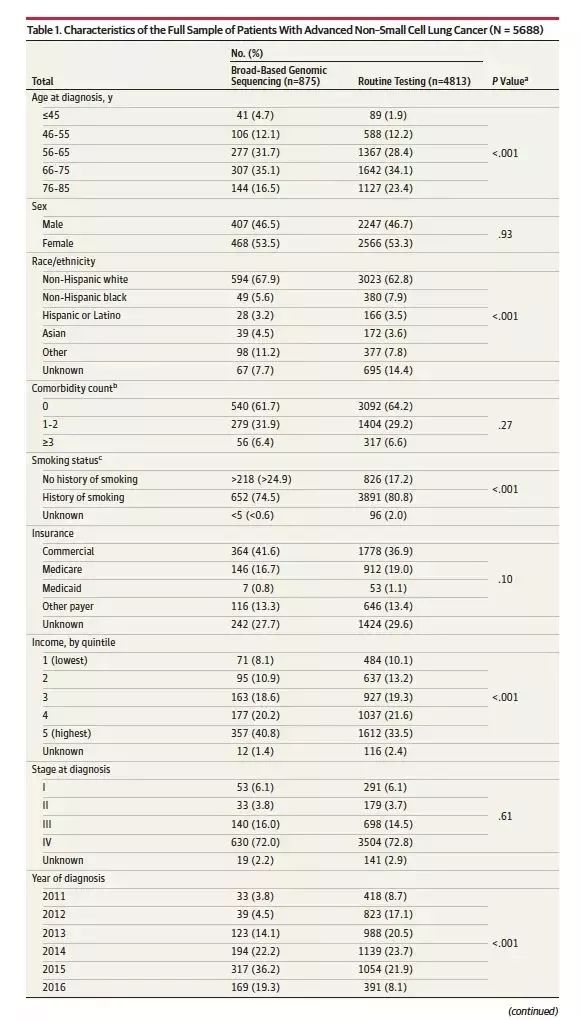
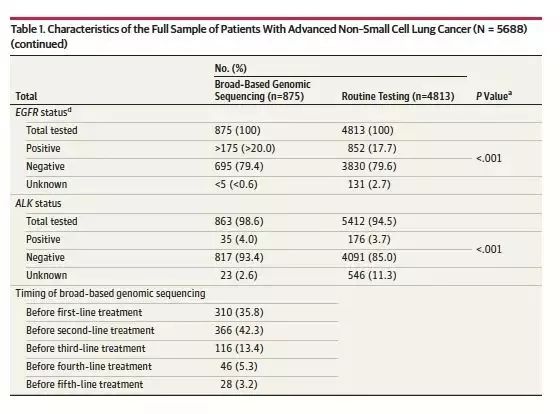
表1. 入组患者的基线特征
总生存分析
在混杂变量分析中,接受常规基因测序和广谱基因测序的患者,12个月的病死率分别为49.2% vs 30.5%(P<0.001)。采用混杂变量分析显示,广谱基因测序和12月的病死率没有显著相关性,预测两组之间12个月的病死率差异为-3.6%[95%CI:-18.4%-11.1%,P=0.63],见下表2。预测12个月的病死率,常规检测组和广谱基因测序组分别为44.4% vs 41.1%。
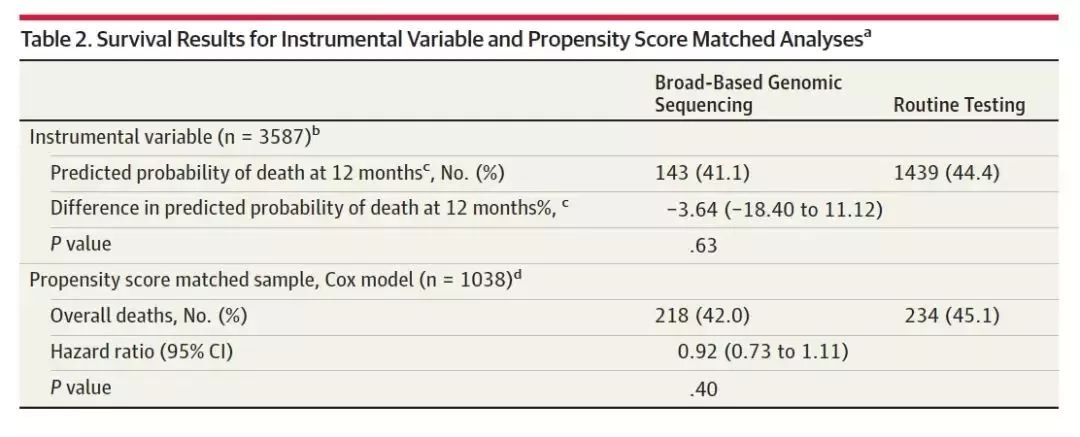
表2. 采用混杂变量分析和倾向性匹配分析的生存结局
在K-M生存分析中,两组未调整的生存曲线存在显著差异,HR 0.69 [95%CI 0.62-0.77],P<0.001,见图1. 倾向性评分分析有80%的检验效能证明两组之间的HR为0.86。倾向性匹配分析中配对了519对患者,两组患者中接受免疫治疗的患者比例均为21.2%,81.2%的患者有完整的树木。分析倾向性匹配分析中配对的患者,接受广谱基因测序和常规基因检测的两组患者,总生存无显著差异,P=0.50,见图2,cox比例风险模型分析,HR为0.92[95%CI 0.73-1.11,P=0.40],见表2.
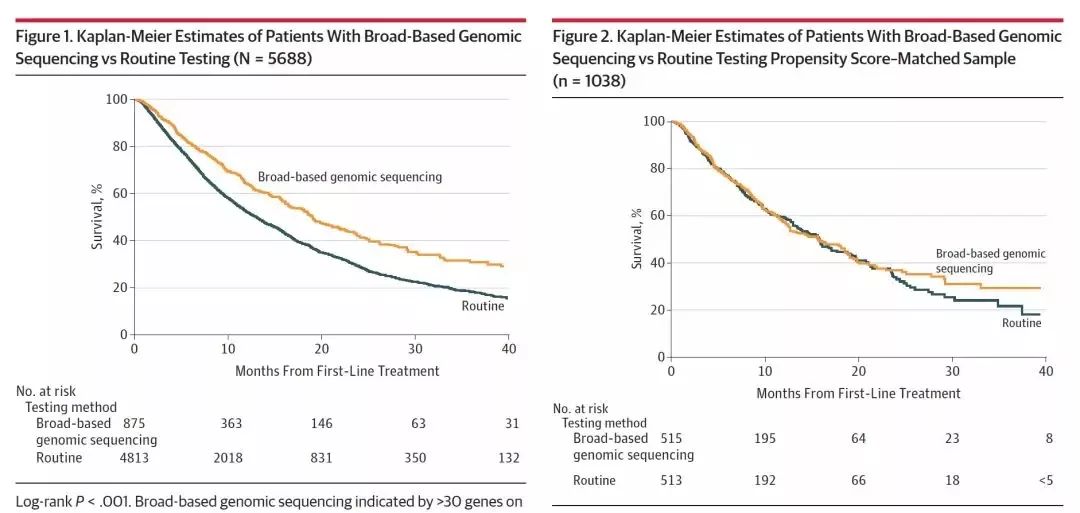
图1. 总体人群中,两组的生存对比;图2. 倾向性匹配分析中配对患者的生存对比
检测到的基因突变
在875例接受广谱基因测序的患者中,大多数患者既往已经接受了一线(35.8%)或二线(42.3%)治疗。在接受广谱基因测序的875例患者中,778例(88.9%)合并基因突变。在检测到的247个不同的基因变异中,TP53突变最常见(55.1%),其次为KRAS(34.2%),EGFR(21.9%),CDKN2A(15.7%),STK11(12.2%)。除EGFR/ALK以外,最常见的可靶向基因变异为BRAF V600E,MET和ERBB2。在同时接受广谱基因检测和常规基因检测的患者中,EGFR突变和ALK重排显示出较高的一致性(98%-99.1%)。
患者接受的治疗
所有入组患者就能接受了一线治疗,仅2688例(47.3%)患者接受了二线治疗。常规基因检测组和广谱基因检测组一线接受靶向治疗和化疗的患者比例相当。然而,接受广谱基因检测的患者,相比于常规基因检测患者,更有可能接受免疫治疗(4.0% vs 1.7%)或参加临床试验(0.6% vs 0.4%),见下表3. 在EGFR/ALK野生型的患者中,接受广谱基因检测的患者,相比于常规基因检测患者,有更高比例患者接受一线靶向治疗,8.3% vs 4.7%,P<0.001。在接受广谱基因检测的患者中,36例(4.5%)接受基因测序指导的靶向治疗,75例(9.8%)接受EGFR/ALK靶向治疗,674例(85.1%)未接受靶向治疗。见表3.
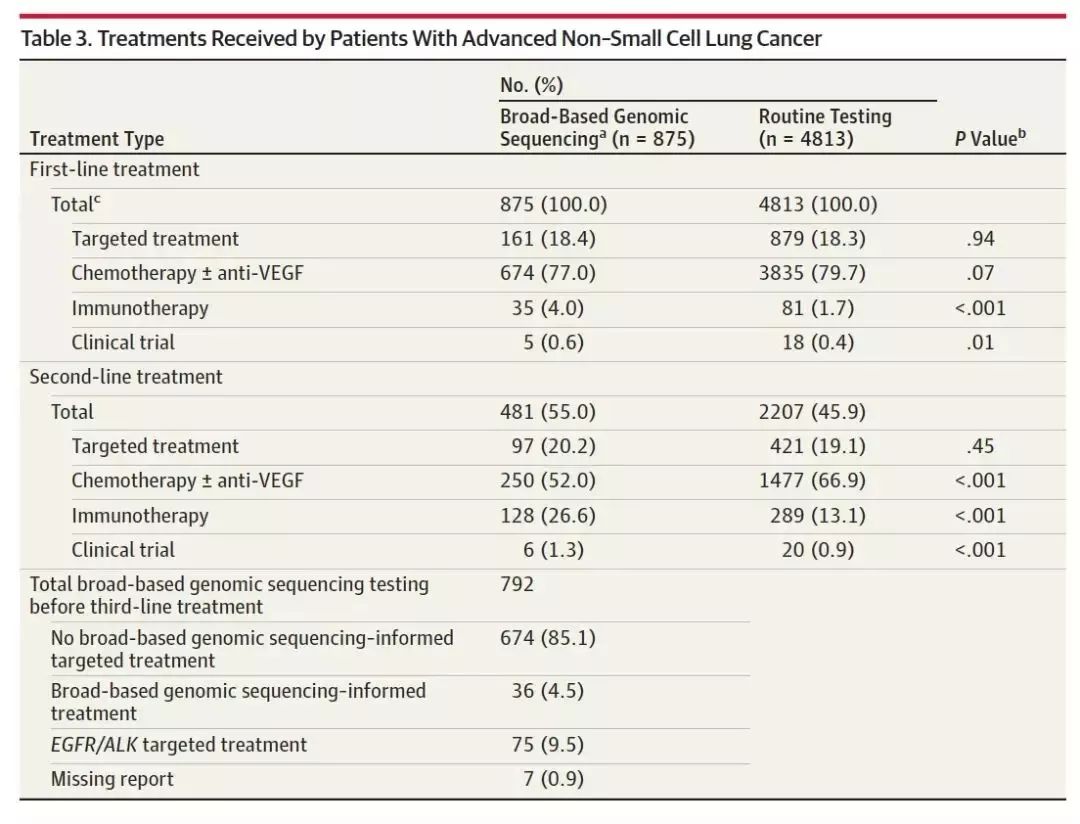
表3. 晚期NSCLC患者接受的治疗
结论和讨论
在社区肿瘤中心接受治疗的晚期NSCLC患者,广谱基因测序可以指导部分患者的治疗,但相比于常规基因检测,并不能改善患者的预后。然而,基于这一研究结果,并不能认为在非鳞NSCLC患者中不应该广谱基因测序。首先,针对驱动突变的靶向治疗,只有接受TKI治疗的患者对比未接受TKI治疗的患者,才能观察到生存的获益。既往来自肺癌突变联盟的分析数据显示,合并驱动突变并接受靶向治疗的患者相比于合并驱动突变但未接受靶向治疗的患者,有显著的生存获益。第二,一线治疗使用特定的TKI可以改善患者的PFS,ORR和QOL,且降低毒性。第三,本研究的时间窗,2011-2016年,刚好在FDA获批针对ROS1重排和BRAF V600E突变的靶向治疗之前。总体而言,多基因检测仍然是未来的趋势。
参考文献
Association of Broad-Based Genomic Sequencing With Survival Among Patients With Advanced Non–Small Cell Lung Cancer in the Community Oncology Setting. JAMA. 2018;320(5):469-477. doi:10.1001/jama.2018.9824(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发