解读|NGS第二弹,诺禾致源NGS-kit审评报告解读
| 导读 | 近期,审评中心这周刚刚发布了《肿瘤相关突变基因检测试剂(高通量测序法)性能评价通用技术审查指导原则(征求意见稿)》,为解决NGS的技术规范问题,提供很多细致的指导。此指导原则虽还在征求意见中,但文末浓墨重彩的描述着实让小编也感到兴奋。“申报产品上市后,通过上市后数据收集和分析或药物标签中说明明确具有伴随诊断用途的基因,在不改变原有反应体系和检测方式等情况,申请人可通过申请变更其临床用途。”此举,让伴随诊断行业看到了新的希望。 |
2018年7月23日,CNDA批准了广州燃石医学检验所有限公司的高通量检测创新产品 “人EGFR/ALK/BRAF/KRAS基因突变联合检测试剂盒(可逆末端终止测序法)”的三类医疗器械产品的注册—— “肿瘤NGS第一证”。


很快的,2018年8月13日,CNDA又批准天津诺禾致源“人EGFR、KRAS、BRAF、PIK3CA、ALK、ROS1基因突变检测试剂盒(半导体测序法)” 的三类医疗器械产品上市。此举意义深远。相信这两款试剂盒将很快面世,投入市场,像世和基因、飞朔生物、华因康基因、艾德生物的NGS产品也将会陆续获批。
根据CMDE公布的审评报告,小编进行如下整理汇编。
试剂组成
首先,产品主要组成成分包括文库构建试剂盒、文库定量试剂盒、模板制备试剂盒、模板制备溶液盒、耗材盒、测序试剂盒、测序溶液盒,共计有7个子试剂盒。相比较,燃石的更简单,选择将组分中的部分子试剂盒进行一类备案。
其次,诺禾的审评报告中未透露说明书,且对试剂盒配套软件未作细致介绍。据了解,诺禾的配套软件按照III类器械进行注册申报,而燃石按照II类申报,且目前已经注册发补阶段,顺利的话年底即可拿证。
适用机型
燃石的盒子是基于illumina平台,适用机型系MiseqDx。据了解,此型号产品illumina公司在2014年即启动进口注册,但至今未获得CNDA批准。诺禾的盒子是基于中山大学达安基因股份有限公司生产的DA8600,注册证号:国械注准20143401961。
预期用途
该产品用于定性检测非小细胞肺癌(NSCLC)肿瘤组织福尔马林固定石蜡包埋切片(FFPE)样本中EGFR、KRAS、BRAF、PIK3CA、ALK、ROS1基因的多种变异。明确样本类型系组织标本。其中,EGFR基因的L858R及19号外显子缺失(19del)突变用于吉非替尼片的伴随诊断检测,T790M突变用于甲磺酸奥希替尼片的伴随诊断检测,ALK融合和ROS1融合用于克唑替尼胶囊的伴随诊断检测。
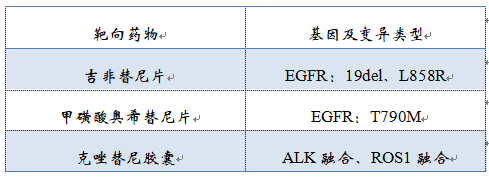
▽伴随诊断用途的基因变异类型及相应的靶向药物
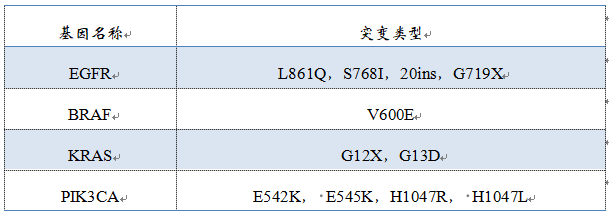
▽未经伴随诊断验证的基因突变类型
跟燃石相比,诺禾增加了ROS1和PIK3CA两个基因,其中更重要的是建立了ROS1和克唑替尼的伴随诊断关系。
临床研究
>>>>(一)与Sanger测序的比较研究——数据完美
1、临床机构:北京大学肿瘤医院,四川大学华西医院,中国人民解放军总医院,河南省肿瘤医院、首都医科大学附属北京胸科医院,共计5家单位。
2、样本例数:总样本2789例。考核试剂共检出1966例阳性样本,阳性率(阳性例数占总样本例数的比例)为:70.49%。其中,1521例EGFR基因突变阳性样本,166例KRAS基因突变阳性样本,43例BRAF基因V600E突变阳性样本,99例PIK3CA基因突变阳性样本,112例ALK基因融合阳性样本,25例ROS1基因融合阳性样本。
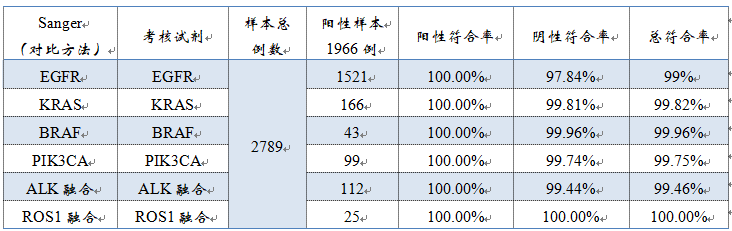
▽考核试剂与Sanger测序比对数据
3、不一致验证:考核试剂与对比试剂检测结果不一致采用相应的已上市qPCR试剂盒进行测定。在 2789 例样本中,两种试剂检测结果不一致的样本共83 例,涉及 86 个位点,其中 62 个位点的 qPCR 检测结果与考核试剂一致, 24 个位点的检测结果与 Sanger 测序一致。不一致的原因,审评报告中未做解释。

▽考核试剂与Sanger测序结果不一致情况
>>>>(二)与已上市qPCR试剂的比较研究——数据依旧完美
1、试验目的:在与Sanger测序比较一致性的的基础上,检验考核试剂和相关已上市qPCR试剂的检测一致性;
2、临床机构:北京大学肿瘤医院、四川大学华西医院、河南省肿瘤医院,共计3家。
3、样本类型:与Sanger测序的一致性临床研究的剩余样本及新入组FFPE样本;
4、不一致性验证:共有8例样本两种试剂检测结果不一致。其中6例在对比试剂复测及Sanger测序中显示突变结果与考核试剂一致,2例显示与对比试剂检测结果一致;
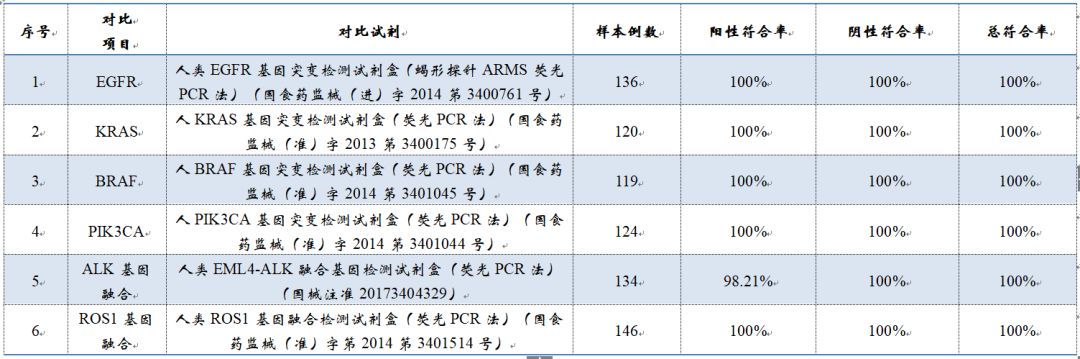
▽考核试剂与已上市qPCR试剂比对数据
>>>>(三)与伴随诊断试剂的比较研究——数据依旧依旧完美
1、试验目的:在一致性临床研究中,也深入评估考核试剂与已经充分联合药物临床评价的伴随诊断试剂的一致性。
2、临床机构:北京大学肿瘤医院、四川大学华西医院、河南省肿瘤医院、首都医科大学附属北京胸科医院,共计4家。
3、样本类型:入组样本为与 Sanger 测序的一致性临床研究的剩余样本及新入组样本,样本病例肿瘤分期符合相关靶向药物对“局部晚期与转移性非小细胞肺癌”的要求。
4、不一致性验证:试验中有1例样本两种试剂检测结果不一致。对比试剂复测及Sanger测序检测显示突变结果与考核试剂一致。

▽考核试剂与已上市CDx试剂比对数据
其中,针对EGFR 19del及L858突变的,CDx选择了凯杰Qiagen的therascreen(R) EGFR RGQ PCR Kit,注册证号:国食药监械(进)字2014第3400761号。T790M与燃石选择的对照品一致,均为Roche的Cobas V2。ALK融合基因与燃石选择的亦相同,同是Abbott的Kit,ROS1融合基因选择是厦门艾德的Kit。注册证号:国食药监械(准)字2014第3401514号。此试剂盒虽未获得CNDA批准用于伴随诊断,但在2017年初获得了日本药品和医疗器械管理局(PMDA)批准,成为全球首个ROS1靶向抑制剂克唑替尼(crizontinib)的伴随诊断试剂。
>>>>(四)TKI 药物疗效相关的回顾性临床研究——稍差于燃石
1、临床机构:北京大学肿瘤医院、四川大学华西医院、河南省肿瘤医院、首都医科大学附属北京胸科医院。共计4家机构。
2、样本类型:针对“与伴随诊断试剂临床研究”中考核试剂检出的阳性样本。
3、不一致验证:且受试者用药前样本经考核试剂检测结果均显示为敏感突变 EGFR(19del)或EGFR(L858R)阳性,T790M阳性,ALK基因融合或ROS1基因融合阳性 ,与临床既往分子检测结果一致。
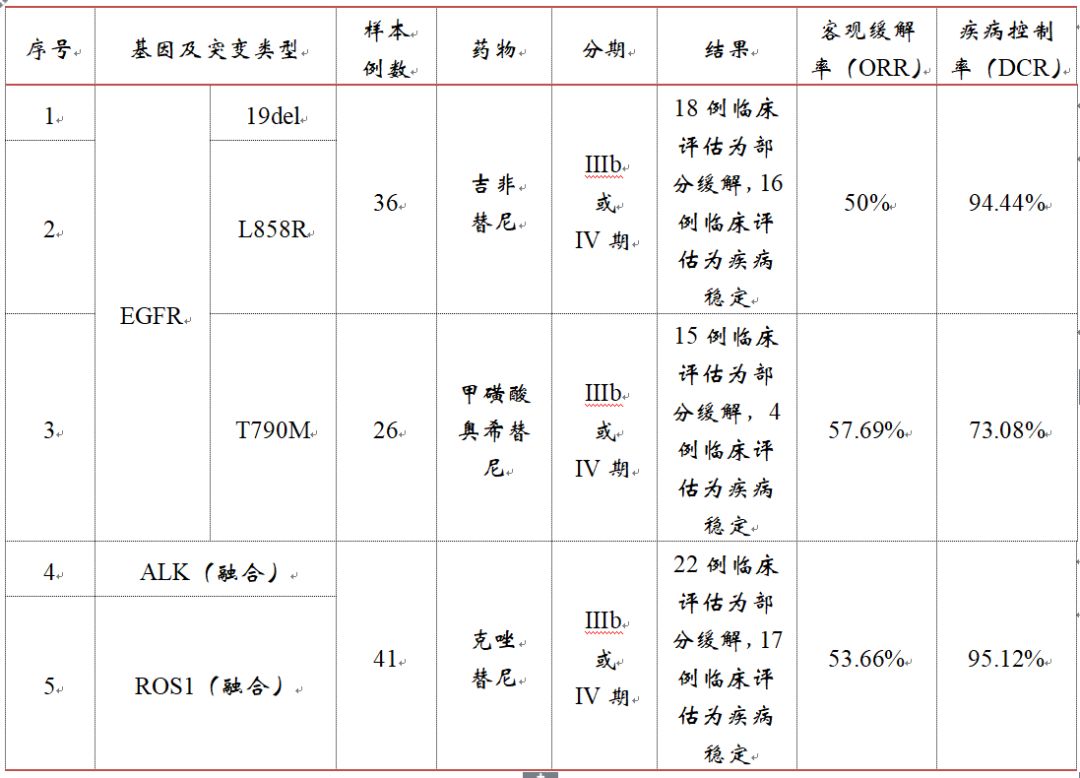
▽考核试剂与已上市CDx试剂比对数据TKI 药物疗效相关的回顾性临床研究结果
小结
其实不难看出,燃石和诺禾Kits的批准过程里,依旧充满了艰辛。但可喜的是,监管层、各方专家和企业一起为之努力。近期,审评中心这周刚刚发布了《肿瘤相关突变基因检测试剂(高通量测序法)性能评价通用技术审查指导原则(征求意见稿)》,为解决NGS的技术规范问题,提供很多细致的指导。此指导原则虽还在征求意见中,但文末浓墨重彩的描述着实让小编也感到兴奋。“申报产品上市后,通过上市后数据收集和分析或药物标签中说明明确具有伴随诊断用途的基因,在不改变原有反应体系和检测方式等情况,申请人可通过申请变更其临床用途。”此举,让伴随诊断行业看到了新的希望。
最后,小编也期待着尽快听到世和基因、飞朔生物、华因康基因、艾德生物的NGS产品的好消息。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发