科普||重大发现!T细胞免疫疗法成功治愈乳腺癌!
| 导读 | 研究结果已于6月4日发表在《Nature Medicine》上.患者是现年52岁的自佛罗里达州工程师Judy Perkins,她在3年前被选中接受该项... |
引言
利用基因工程手段对免疫细胞进行改造来直接瞄准肿瘤形成的CAR-T疗法是目前癌症治疗中最令人兴奋的进展之一。在这种方法中,T细胞从病人体内取出,并在体外进行改造,使T细胞表达表面嵌合抗原受体(CAR),当细胞被转移回体内时,CAR会像"汽车"一样,直接把T细胞 "运载"到病人的肿瘤上。这种方法成功治愈乳腺癌
根据本周《自然-医学》在线发表的一篇论文Immune recognition of somatic mutations leading to complete durable regression in metastatic breast cancer,一位患者的免疫系统经过调整后完全消除了乳腺癌细胞,为所有常规治疗无效的晚期癌症提供了一种可能的治疗方法。这是T细胞免疫疗法首次成功应用于晚期乳腺癌。
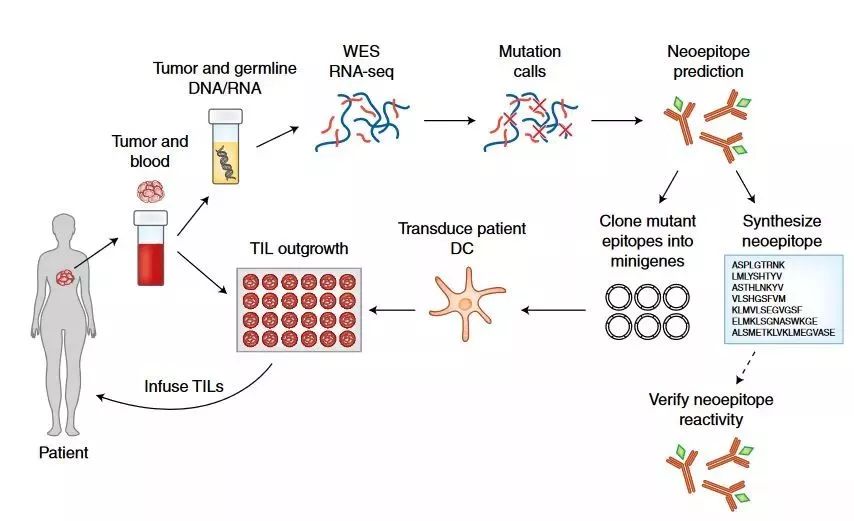
Fig. 1: 过继性T细胞疗法成功治疗了荷尔蒙受体阳性的转移乳腺癌。
图片来源:新闻与观点文章
治疗癌症最成功的临床免疫治疗方法是免疫检查点阻断和过继性T细胞疗法。免疫检查点阻断是通过注射抗体,在患者体内激活T细胞。而在过继性T细胞疗法中,T细胞取自患者的血液或肿瘤,只有那些识别肿瘤的T细胞会被培养,并在之后返回到患者体内。这些方法的成功率因癌症类型的不同而有很大差异。
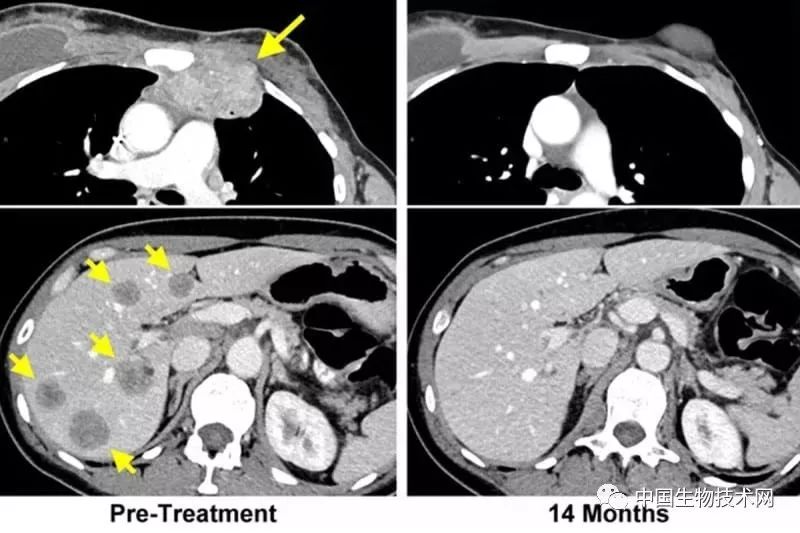
近日,科学家开发的一种新型免疫疗法,使一位乳腺癌晚期患者的癌细胞完全消退,并且效果已维持了近2年。而在此之前,该患者已尝试所有常规治疗方法,且都以失败告终。这项研究由美国国立卫生研究院(NIH)国家癌症研究所(NCI)Steven Rosenberg博士领导。研究结果已于6月4日发表在《Nature Medicine》上。

患者是现年52岁的自佛罗里达州工程师Judy Perkins,她在3年前被选中接受该项治疗。而在此前的2003年,Perkins曾因乳腺癌做过乳房切除手术,但在3年前接受治疗之前她体内的癌细胞又回来了,并且扩散至肝脏。

Judy Perkins已恢复正常生活 图片来源:华盛顿邮报
值得注意的是,从目前的临床数据来看,治疗癌症最成功的临床免疫治疗方法是免疫检查点阻断和过继性T细胞疗法(ACT)。免疫检查点阻断是通过注射抗体,在患者体内激活T细胞。而在过继性T细胞疗法中,T细胞取自患者的血液或肿瘤,那些能识别肿瘤的T细胞会被体外培养增殖,随后回输至患者体内。炙手可热的CAR-T疗法即属于过继性T细胞疗法。但这些方法并不是普遍奏效,成功率因癌症类型的不同而有很大差异。迄今为止,使用免疫检查点阻断方法治疗乳腺癌的临床试验均被证明无效。
整个治疗过程基于Judy Perkins自身的抗体。研究团队采集了Perkins的肿瘤组织并对其DNA进行了测序,他们还对肿瘤浸润淋巴细胞(TILs)进行了采样。所谓的肿瘤浸润淋巴细胞是指那些离开血流进入到肿瘤中的白细胞,当存在大量的肿瘤浸润淋巴细胞时,表明机体启动了对抗肿瘤的免疫反应。研究团队确定患者病例中特定的突变后,利用突变信息找到能够最有效瞄准这些突变的T细胞,最后提取出专门患者肿瘤中细胞突变的T细胞。
这些免疫细胞经过体外培养后,重新注入到Perkins体内。同时,研究团队联合使用了免疫增强药物白细胞介素2和另一种“明星抗癌药”PD-1抑制剂Keytruda,Keytruda即属于另一种免疫疗法免疫检查点阻断,在某些癌症中有显著的效果。
当时49岁的Perkins首先是接受了化疗来阻止右侧乳房中的肿瘤继续生长,但是以失败告终。之后她被选择接受这种新型疗法。期间,肿瘤还扩散到了她的肝脏和其他部位,这也是医生们决定对她进行免疫治疗的决定因素之一。幸运的是,治疗结果非常成功:她体内的癌细胞被完全清除了,即使两年后,医生们也没有在她体内发现癌细胞的踪迹。这是该方法首次取得成功。根据NCI外科主任Steven Rosenberg的说法,研究人员在过去曾经利用该技术使六位罹患结肠癌或宫颈癌患者难以治疗的肿瘤缩小了。
这项研究成果令人印象深刻的地方在于,乳腺癌与前列腺癌和卵巢癌类似,它们很少发生突变,这使得免疫系统很难分辨并攻击它们。
“我们开发了一种高通量的方法来鉴定癌症中存在的免疫系统识别的突变,”Rosenberg博士说。“这项研究现在是实验性的,但是因为这种免疫疗法的新方法取决于突变,而不是癌症类型,所以它在某种意义上是我们可以用于治疗许多类型癌症的蓝图。”
免疫疗法并非新技术,但是它的成功率通常不稳定。Alan Melcher教授是癌症研究所的免疫疗法专家。他说,这项“精彩”的研究表明了我们在将免疫系统反应的基础生物学原理转化为现实有效的癌症疗法方面取得了巨大的成功,这对于女性尤为有益。然而,现在并不确定这项技术是否对所有癌症患者都有效,这种疗法的成功率很有可能并不是很高。
目前,这是一项非常有前景的研究,但是仅仅成功了一例。我们还需要确定这些结果是否能在更多的受试样本上取得效果。这种疗法复杂且昂贵,每位病人治疗花费高达500000美元,所以还需要很长时间才可以被大规模应用。
NCI癌症研究中心的Tom Misteli博士说:“这个典型案例再一次表明了免疫疗法的力量。如果能在更大型的研究中进一步确认结果,那么这种T细胞疗法就很有希望被用于更多种类癌症的治疗。”
一个CAR-T细胞居然干掉了整个肿瘤
Fraietta等在Nature发表了一篇题为"Disruption of TET2 promotes the therapeutic efficacy of CD19-targeted T cells"的文章,报告了一种偶然发现的TET2基因,破坏后对CAR-T细胞的治疗产生了积极的作用,一个CAR-T细胞居然"干"掉了整个肿瘤。
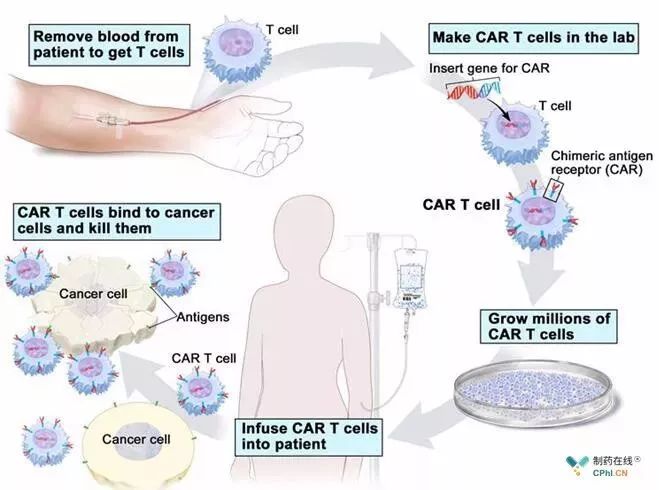
CAR-T细胞治疗过程
[来源:USA National Cancer Institute]
CAR-T细胞在体外改造过程中,需使用逆转录病毒或慢病毒的病毒载体将DNA序列插入到人的T细胞基因组中。由于无法控制序列在基因组中插入的位置,这就有可能破坏另一个重要基因。在21世纪初,在一项针对免疫缺陷患者的基因疗法临床试验中,使用病毒载体将野生型免疫拷贝基因插入到干细胞过程中,不恰当的插入使LMO2基因序列不能正常表达,使一些病人出现了T细胞的恶性增殖,并发展为T细胞白血病。尽管病毒载体随机整合通常被认为是安全的,但任何对基因组的破坏都会带来不良后果的风险。
Fraietta等人在一项针对表达CD19慢性淋巴细胞白血病病人的临床试验中,发现有一个病人在接受第二剂T细胞后的两个月,开始对治疗表现出明显的反应。正常情况下,如果治疗成功,肿瘤消除通常在一个月内发生,因此作者研究了这种非正常情况下延迟的原因,结果发现,插入的CAR序列破坏了TET2基因,对临床结果产生了有益的影响。研究者分析了肿瘤消除过程中最高浓度下血液中CAR-T细胞。他们惊齐地发现,这些T细胞种群几乎完全是由同一个细胞产生。这个单细胞的后代会随着时间的推移而分裂,直到细胞的后代达到一个临界点,从而消除了整个肿瘤。这就提出了一个问题,为什么仅仅一个CAR-T细胞却产生了如此有效的抗肿瘤反应?
结果发现,在这种T细胞的克隆种群中,CAR序列插入了TET2基因中,使TET2基因发生了突变,产生了缺乏TET2蛋白的T细胞。TET2是一种酶,也被称为甲基胞嘧啶加二氧酶,它催化一种羟化反应,这种酶可以将附着在DNA上的甲基(CH3)基团转换成羟甲基(CH2OH),这种对DNA或其相关蛋白的修饰被称为表观遗传修饰,在某些情况下会影响基因表达(图1)。因此,研究者发现虽然病人体内正常T细胞和CAR-T细胞总的表观遗传特征相似,但在CAR-T细胞中观察到了DNA结构的差异,包括CD28、ICOS和干扰素基因。
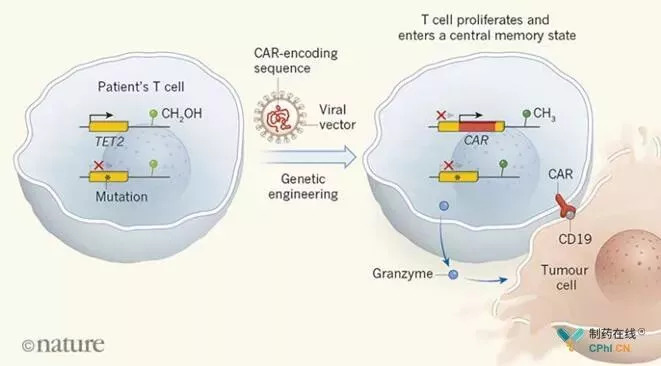
TET2基因缺陷引起T细胞杀伤肿瘤作用机理
[来源:Nature]
先前研究表明,TET2突变与克隆的血细胞改变有关,可能增加疾病或血液癌症的风险(一种被称为克隆血生成的现象)。然而,缺乏TET2的患者T细胞并没有产生异常的T细胞增殖。在肿瘤消除后,CAR-T细胞的数量适当减少,正常T细胞亚群增加。
作者利用基因工程在体外移除了人T细胞中的TET2基因。通过对这些细胞进行分析,发现TET2蛋白的缺失可以增加和延长T细胞处在中央记忆状态的细胞状态下。这种状态有助于防止细胞进入衰竭的功能失调的模式,从而增加T细胞的功能。TET2的缺失也与T细胞记忆的增加有关。研究者还观察到,缺乏TET2的人类T细胞比具有TET2的T细胞产生更少的细胞因子。破坏TET2后穿孔素酶和颗粒酶水平提高,后者是T细胞肿瘤杀伤机制的组成部分。
这些发现表明,针对人类T细胞的TET2蛋白或基因,通过药物介导或基因编辑技术,可以提高其他患者的CAR-T细胞治疗的有效性。如果是这样的话,以后需要的T细胞的剂量可能只是几个细胞,而不是通常的5000万到5亿个细胞。这将缩短CAR-T细胞的生产时间,降低生产成本。
小鼠模型中,在基因组中插入一个CAR序列改变原始基因组序列编码,已经表现出了增强CAR-T细胞活性和持久性的功效[Eyquem, Justin, et al. Nature 543.7643 (2017): 113.]。其他多个小组已经报告了CAR-T细胞疗法解除免疫检查点信号通路对T细胞抑制作用的研究进展[Ren, Jiangtao, et al. Clinical cancer research 23.9 (2017): 2255-2266.]。因此,直接对基因进行编辑,或许真是一种良好的提高CAR-T疗法的策略。
目前,提高CAR-T细胞功能是当前重要的研究领域之一,在之前的文章中,我们也总结了当前增强CAR-T在实体瘤中疗效的策略,多种改善CAR-T细胞疗法的策略均在动物模型中表现出了良好的效果,但是否存在一种策略比其他所有方法更优秀呢?不幸的是,动物研究并不总是和人体内结果相一致,所以临床试验是唯一能明确回答这个问题的方式。好消息是,这些策略似乎都能提高CAR-T的疗效和安全性,因此,人们希望在未来的几年里,T细胞疗法能够给癌症治疗带来更多实惠和惊喜,越来越成功。
来源:
1. https://www.nature.com/articles
2. Fraietta, et al. Disruption of TET2 promotes the therapeutic efficacy of CD19-targeted T cells. Nature. doi:10.1038/s41586-018-0178-z
超级T细胞受体有助杀死遭受HIV感染的细胞
图片来自Luismmolina/iStock。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发