中国科学家首次通过人类胚胎碱基编辑纠正马凡综合征的致病突变丨医麦猛爆料
| 导读 | 2015年,中国报告了世界首例人类胚胎基因编辑,对无活力胚胎(不能存活)中一个有可能导致地中海贫血症的基因进行了修改。紧接着,美国国家科学院(NAS)和美国国家医学院(NAM)召开了国际峰会,得出的结论是由于持续的安全问题和缺乏社会共识,实际上试图从这种改良的种系中产生人类怀孕是“不负责任的”。然而,人类胚胎的基因编辑在过去几年中随着研究的推进而逐渐被人们所接受。 |
2015年,中国报告了世界首例人类胚胎基因编辑,对无活力胚胎(不能存活)中一个有可能导致地中海贫血症的基因进行了修改。紧接着,美国国家科学院(NAS)和美国国家医学院(NAM)召开了国际峰会,得出的结论是由于持续的安全问题和缺乏社会共识,实际上试图从这种改良的种系中产生人类怀孕是“不负责任的”。
然而,人类胚胎的基因编辑在过去几年中随着研究的推进而逐渐被人们所接受。
2017年,NAS和NAM的一份报告指出了将来可以允许胚胎编辑用于遗传性疾病的临床试验,但仅限于严格监督下的严重情况。上个月,英国的纳菲尔德生物伦理委员会表示,在某些情况下,可遗传的基因组编辑可能“在道德上是可接受的”。
7月底,皮尤研究委员会发布的一项研究发现,72%的美国人认为改变未出生婴儿的DNA来治疗严重疾病将是基因编辑技术的适当使用。
近日,来自上海科技大学的黄行许教授和广州医科大学附属第三医院的刘见桥领导的研究小组从MFS患者捐赠的健康卵子和精子着手,利用体外受精技术(IVF)制备成能自行发育的人类胚胎,通过碱基编辑技术成功修复胚胎中导致马凡综合征(MFS)的致病突变。
该研究于8月14日以手稿形式发表在Molecular Therapy上,代表着在重塑人类胚胎DNA尝试的基础上又取得重大进展。

马凡综合征(MFS)
据估计,全球每5,000人中就有1人患有马凡综合征(MFS),这是一种影响身体结缔组织的常染色体显性遗传病。这种疾病由FBN1(编码原纤维蛋白1)基因中单个碱基的突变引起,几乎可以影响身体的任何部位,从松弛的关节、弱视到心脏壁上危及生命的裂缝。
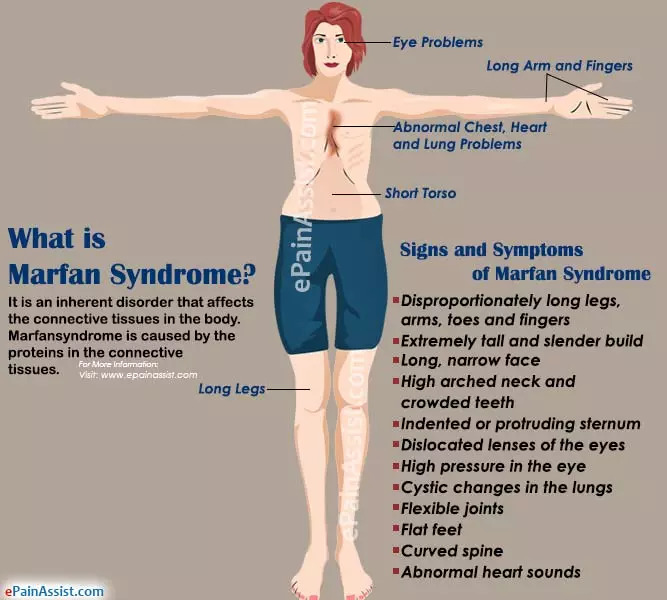
马凡综合征(图片来源:Epainassist)
胚胎基因编辑更好的方式?
研究中,没有使用典型的CRISPR/Cas9基因编辑技术,用于修正MFS致病突变的是哈佛大学David Liu实验室于2016年开发的碱基编辑器,但他并没有参与这项新研究。针对这项研究,David Liu说:“这很好地展示了如何使用碱基编辑器来修正一个众所周知的点突变。这种点突变在一个可能与治疗相关的环境中引发人类遗传疾病。”
碱基编辑器(BE)系统由将脱氨酶与dCas9蛋白融合,通过C-to-T或G-to-A转换编辑特定位点而不形成双链DNA断裂(DSB),并且无需供体,相对于CRISPR/Cas9具有低脱靶效应。提供了更安全的基因组编辑工具。BE已应用于植物和动物,并显示出精确基因组编辑的巨大优势。
之所以选择研究MFS,是因为致病突变中所有需要纠正的都是将FBN1基因中的突变的鸟嘌呤(G)改为健康的腺嘌呤(A),具有被BE修复潜力。
实验结果
-
HEK293T细胞
在进行胚胎编辑之前,研究人员首先确定了细胞模型中产生相应突变并且用BE编辑器修复的可能性。他们在来源于人胚胎肾细胞的HEK293T细胞中使用CRISPR/Cas9诱导产生FBN1的T7498C突变,证实该方法可以实现精确的致病突变。同时,通过Sanger测序,他们还彻底分析了突变位点周围的序列,发现它适合使用BE编辑系统进行校正。
建立起相应的MFS细胞模型后,他们用校正的sgRNA和表达BE3的质粒转染上述该细胞。3天后,收集细胞,提取基因组DNA并用作模板以扩增靶序列,然后对PCR产物进行Sanger测序。结果显示,在靶位点中观察到双峰,表明发生了校正事件。
为了确认突变的校正,对PCR产物进行TA克隆并测序。结果显示,编辑了20个克隆中的10个(50%)。在这些编辑的克隆中,8个在7498处具有期望的C-to-T校正,而其余2个在7498处具有不希望的C-to-G转换或在其他非靶位置处具有C-to-T转换。
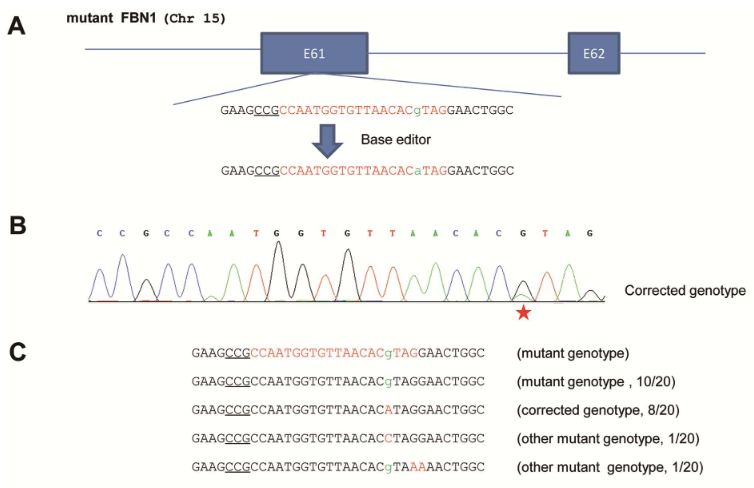
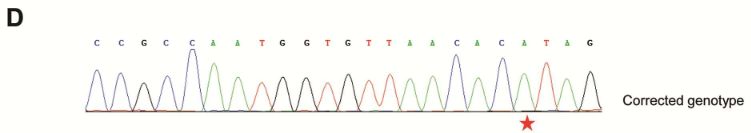
HEK293T细胞结果
总的来说,BE编辑系统对T7498C等位基因校正的整体效率很高。
-
胚胎
该研究经广州医科大学附属第三医院伦理委员会批准。所有相关的临床和实验程序均在广州医科大学附属第三医院生殖医学中心进行。
在获得个体捐献者的知情同意的情况下,研究人员收集了未成熟的卵母细胞用于研究。收集的卵母细胞首先进行体外成熟,然后将成熟的卵母细胞与具有杂合T7498C突变的MFS患者捐赠的精子用于IVF 。
16-18小时后,收集了所有受精卵,并且其中一些被显微注射含有校正sgRNA的BE编辑系统。作为对照,其他受精卵使用含乱序sgRNA的BE编辑系统进行类似的显微注射。他们让胚胎在实验室中又存活了2天,时间长到足够进行测试,看看编辑的效果如何。
总共获得7个测试和7个对照胚胎,其显示出明显正常的发育。所有样品用于全基因组扩增,然后通过Sanger测序进行基因分型。根据序列色谱图,所有测试胚胎在7498位点显示A,而7个对照胚胎中有3个携带G(约50%,如预期),表明测试胚胎中的等位基因校正发生在接近100%的速率。然而,在胚胎-7中检测到除了期望的校正之外的C-to-T转换。
为了进一步表征,研究人员使用另外11个胚胎进行重复测试。对靶位点的PCR产物进行的测序显示,其中10个编辑的胚胎在7498位点产生完全转化,除了胚胎-9,其在7498位点处具有约60%的G-to-A。这些结果显示BE介导了胚胎中致病突变的有效校正。
为了彻底表征编辑结果,他们通过深度测序综合分析了之前所有7个测试样品和来自具有杂合基因型的3个对照样品。结果显示,所有3个对照胚胎都有近一半的野生型和一半的突变等位基因。对于测试胚胎,6个胚胎显示100%野生型等位基因,没有其他碱基转换或插入缺失。
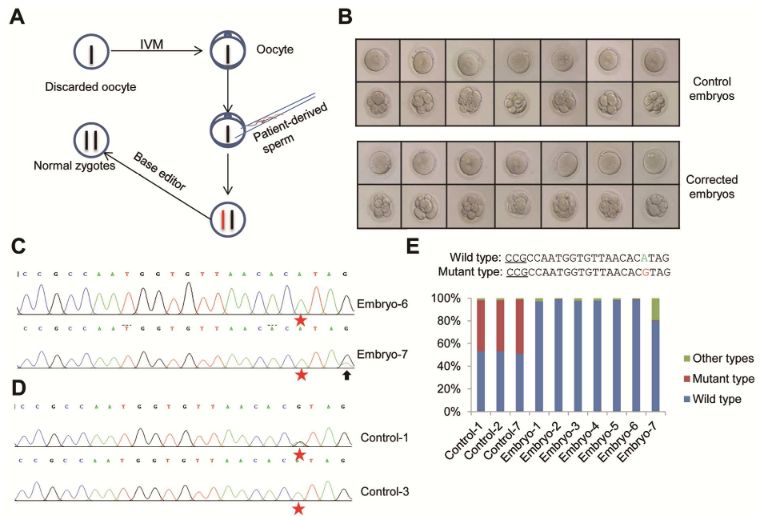
胚胎中的编辑结果
总的来说,所有18个测试胚胎均已被编辑,其中16个胚胎仅携带FBN1基因经过修正的版本,而在2个胚胎中发生了额外的编辑。此前,人类胚胎基因编辑的最成功例子是去年由中美韩科学家领导的一项基于标准的CRISPR“剪刀”的研究,在58个胚胎中的42个修正了导致遗传性心脏病的突变。
此外,鉴于脱靶诱变是基因组编辑的主要关注点,使用来自7个测试样品和3个对照样品的PCR扩增32个具有高达4个核苷酸错配的校正sgRNA的潜在脱靶位点。深度测序的数据分析显示没有检测到脱靶和插入缺失。
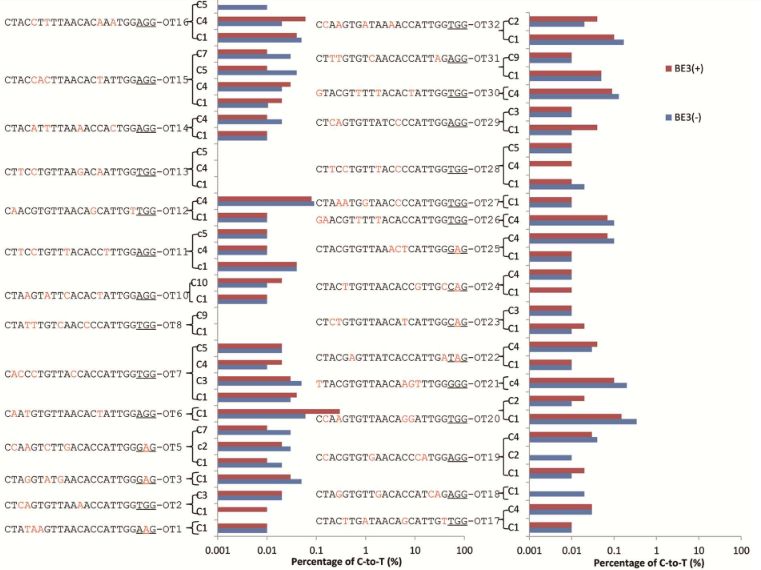
深度测序结果
“总的来说,这项试点研究提供了概念验证,并开启了基于基因编辑的基因治疗的潜力,”上海科技大学的研究员黄行许告诉STAT。“尽管如此,在临床转化仍有很长的路要走。”
碱基编辑器
如果说CRISPR是一把分子剪刀,那么David Liu的碱基编辑器就更像是一支带有吱吱作响的新橡皮擦的铅笔。David Liu说:“尽管有超过50本期刊使用了碱基编辑器,但整个碱基编辑领域只存在了2年左右,还需要进行额外的研究来评估碱基编辑的可能后果,能合理检测到多少就评估多少。”
而其中一些研究正在Beam Therapeutics公司进行,一家于今年早些时候由David Liu与CRISPR先驱张锋共同创办的一家初创企业。Beam Therapeutics与哈佛大学签订的第一份许可协议涵盖了CBE碱基编辑器,可进行C-to-T或G-to-A的编辑。第二个涉及ABE碱基编辑器,它可以执行T-to-C或A-to-G的编辑,就像用于修正MFS突变的碱基编辑器一样。

Beam Therapeutics首席执行官约翰·埃文斯表示,“该公司专注于利用碱基编辑技术来治疗儿童和成人的严重疾病,而非进行胚胎编辑。在全社会准备考虑胚胎编辑之前,人们需要多加考虑,我们期待参与讨论。”(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发