《柳叶刀》子刊:突破!科学家首次证实,基于CT影像的人工智能算法可以判断癌症患者能否从免疫治疗中获益 | 临床大发现
| 导读 | 目前的临床统计显示,PD-1抑制剂只能在20%-50%的晚期实体瘤病人中发挥作用。受益的患者究竟是谁?目前找到这些患者的手段有限。因此,找到一种可靠的生物标志来指导免疫治疗迫在眉睫! |
免疫治疗在癌症统治的世界里不断攻城略地。
癌症患者看到了生的希望,但遗憾的是患者很难知道自己究竟是不是免疫治疗泽被的那些人。
目前的临床统计显示,PD-1抑制剂只能在20%-50%的晚期实体瘤病人中发挥作用[1]。受益的患者究竟是谁?目前找到这些患者的手段有限。
因此,找到一种可靠的生物标志来指导免疫治疗迫在眉睫!
近日,来自法国的Eric Deutsch博士团队借助人工智能之力,给我们带来了新的希望。他们用癌症患者的CT图像训练人工智能,得到一个可以通过患者的CT影像准确预测PD-1抑制剂治疗效果的人工智能平台。
 左一为Eric Deutsch博士
左一为Eric Deutsch博士这个人工智能平台可以区分患者对免疫治疗响应的程度,那些被认为有效的患者的中位生存期(24.3个月),比预测无效患者的中位生存期(11.5个月),提高了一倍以上(延长了1年多),效果相当明显!这项成果发表在最新一期的《柳叶刀-肿瘤学》上[2]。
你可能会疑惑,免疫治疗不是分子层面的吗?而CT成像可是肉眼可见的宏观层面,这两者是如何结合在一起的呢?
这就是人工智能的魅力所在了,让奇点糕为你慢慢道来。

首先,我们来看看到底免疫治疗会对什么样的肿瘤起作用。
说起免疫治疗,我们都知道是借助我们自身的免疫系统攻击肿瘤。那肿瘤里面或者附近必须得有充足的免疫细胞,对吧。
之前有报道,免疫治疗的效果和肿瘤是否被免疫细胞浸润有关 [ 3, 4, 5, 6]。如果肿瘤组织中有丰富的CD8细胞(又叫细胞毒性T细胞),而且肿瘤细胞还大量表达PD-L1等检查点标志物,还有大量的基因突变的话,这些肿瘤往往对免疫疗法有反应[7, 8, 9]。
所以啊,现在有一些方法,例如分析肿瘤组织的PD-L1表达水平,或者分析肿瘤组织的突变负荷。可以在一定程度上预测患者对免疫治疗的响应程度,但是目前的研究表明,仅靠这两个手段还不够啊。
而且这两个预测方法还有个比较明显的缺憾是,都需要做肿瘤组织活检。
Deutsch博士想到了CT成像。
现在高维医学成像已经能在宏观上把肿瘤看得明明白白。但是科学家的野心不止于此,他们希望能用这双火眼金睛,直接看到肿瘤组织的细胞和分子层面上去,彻底认清肿瘤的本质。
也就是说,Deutsch博士团队直接想从患者肿瘤组织的CT影像上看出肿瘤里面的免疫细胞水平,然后预测患者对免疫治疗响应的程度。
于是Deutsch博士就有了一个大胆的设想——在人工智能的帮助下,用医学成像去指导免疫治疗。
说干就干,科学家们很快就将这个想法付诸行动了。
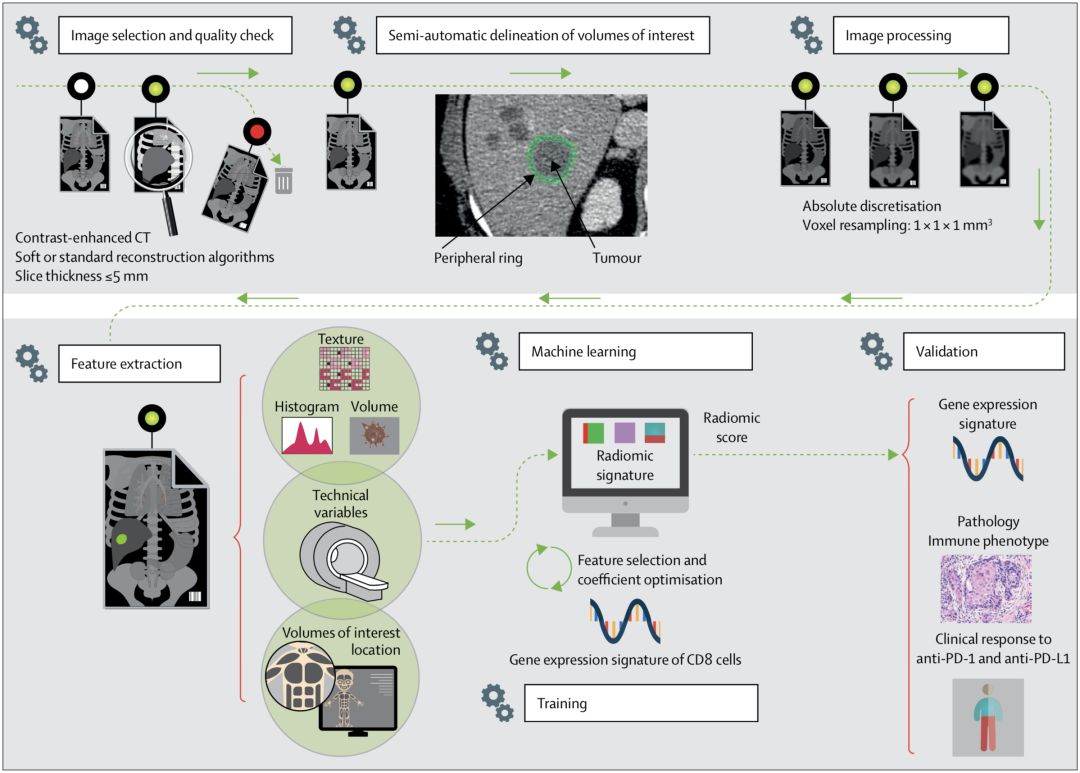
他们选取了一个叫MOSCATO的队列[10],这个队列的135名患者都患有晚期实体瘤,并且他们的CT图像以及肿瘤组织的转录组测序数据都有保存。其中,这些转录组测序数据可以用来计算肿瘤中CD8细胞的数量。
别看只有135个患者的数据影像和转录组数据,这些数据里面蕴藏的信息那真是海量,人力完全没办法分析。
所以,研究人员就一股脑将这些数据交给了机器学习平台,让机器自己去寻找规律。没有让研究人员失望,机器学习帮助他们找到了规律,开发出了一个可以预测肿瘤组织中免疫细胞数量的算法。
 人工智能训练流程
人工智能训练流程
但这个算法是不是靠谱还需要进一步验证。
研究者们又用了一个叫TCGA队列[11,12],包括119名患者,这些患者也都有CT图像和转录组测序数据。用算法计算这队列的CD8细胞数量,与对应转录组数据计算的数量一致,表明算法是可靠的。
不过,这只能说明这个算法从CT图像上读取的免疫细胞信息,能和肿瘤组织转录组反应的肿瘤细胞信息一致。
到底准不准,还得靠实践来检验。
于是,研究人员又找到了第三个队列。这个队列共有100名患者,这个队列的独特之处在于,所有患者的肿瘤组织都被准确的分型了。意思就是,这些患者肿瘤组织的免疫细胞情况是已知的。
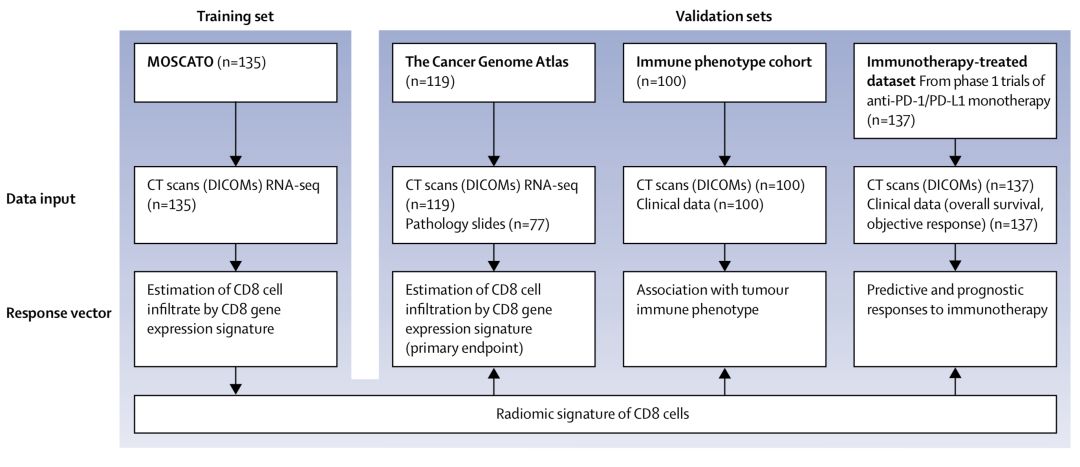 1个队列训练算法,3个队列验证
1个队列训练算法,3个队列验证
这100名患者的肿瘤组织被分成了3种类型:免疫浸润型,免疫排斥型,和免疫荒漠型[13]。免疫浸润型的肿瘤被免疫细胞大量渗透;免疫排斥型则会阻止T细胞浸润;而免疫荒漠型的肿瘤几乎没有T细胞浸润。
分析结果表明,通过算法给图像评分,评分预测的免疫表型可以很好地与已知结果对应上。这一关也过了。
既然能判断免疫表型,那这个表型能预测免疫治疗的效果吗?算法还要经历最终极的考验。
最后的检验队列包括137名患者,都接受过免疫治疗,治疗后经过了随访,随访的中位值是16.5个月[14, 15]。
利用久经检验的人工智能平台对随访记录进行分析研究发现,在治疗的头三个月,评分高的患者(23%)对治疗有反应,而评分低的患者(77%)没有反应,不过差距并不显著。但是在第六个月,这个差距变得非常明显。
更重要的是,评分高的患者的中位生存期(24.3个月)明显高于评分低的患者(11.5个月),中位生存期提升1年以上,效果非常明显,终极考验通过!
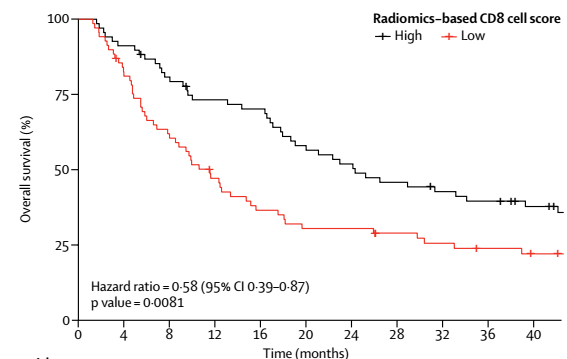 患者经免疫治疗后的中位生存期
患者经免疫治疗后的中位生存期
至此,我们可以说,这个利用人工智能得到的影像信号,能出色地预测免疫治疗的效果!
当然,要真正走向实际应用,在这项回顾性试验的基础上,还需进行临床试验。事实上,这一天也不会等很久,到目前,已经有27个利用影像数据指导临床肿瘤治疗的试验已经登记(ClinicalTrials.gov)。
而且,这个项研究还存在一些局限性,比如肿瘤还存在更多的免疫亚型[16],影像信号还需要做到更加精细的区分,以便于对免疫疗法做出更准确的指导。
尽管如此,我们仍对人工智能加持的影像组学充满期待。相比组织活检,CT扫描是无创的,对身体没有伤害,对于那些不适合或者不愿意做组织活检患者而言,这无疑是个更好的选择。此外,相对于测序,影像检查也更加廉价,也是一个不小的优势。
人工智能在疾病治疗中的应用越来越多,相信未来会有更多的疑难杂症会被克服。而现在,癌症免疫治疗检测的新时代要来临了!
参考资料:
[1]Chen DS, Mellman I. Elements of cancer immunity and the cancer-immune set point. Nature 2017; 541: 321–30.
[2]https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(18)30413-3/fulltext
[3] Chen DS, Mellman I. Elements of cancer immunity and the cancer-immune set point. Nature 2017; 541: 321–30.
[4] Herbst RS, Soria JC, Kowanetz M, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients. Nature 2014; 515: 563–67.
[5] Kim JM, Chen DS. Immune escape to PD-L1/PD-1 blockade: seven steps to success (or failure). Ann Oncol 2016; 27: 1492–504.
[6] Hugo W, Zaretsky JM, Sun L, et al. Genomic and transcriptomic features of response to anti-PD-1 therapy in metastatic melanoma. Cell 2016; 165: 35–44
[7] Herbst RS, Soria JC, Kowanetz M, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients. Nature 2014; 515: 563–67.
[8] Hegde PS, Karanikas V, Evers S. The where, the when, and the how of immune monitoring for cancer immunotherapies in the era of checkpoint inhibition. Clin Cancer Res 2016; 22: 1865–74.
[9] Tumeh PC, Harview CL, Yearley JH, et al. PD-1 blockade induces responses by inhibiting adaptive immune resistance. Nature 2014; 515: 568–71.
[10] Massard C, Michiels S, Ferté C, et al. High-throughput genomics and clinical outcome in hard-to-treat advanced cancers: results of the MOSCATO 01 trial. Cancer Discov 2017; 7: 586–95.
[11] Clark K, Vendt B, Smith K, et al. The Cancer Imaging Archive (TCIA): maintaining and operating a public information repository. J Digit Imaging 2013; 26: 1045–57.
[12] Weinstein JN, Collisson EA, Mills GB, et al. The Cancer Genome Atlas Pan-Cancer analysis project. Nat Genet 2013; 45: 1113–20
[13] Hegde PS, Karanikas V, Evers S. The where, the when, and the how of immune monitoring for cancer immunotherapies in the era of checkpoint inhibition. Clin Cancer Res 2016; 22: 1865–74.
[14] Champiat S, Dercle L, Ammari S, et al. Hyperprogressive disease is a new pattern of progression in cancer patients treated by anti-PD-1/PD-L1. Clin Cancer Res 2017; 23: 1920–28.
[15] Sun R, Champiat S, Dercle L, et al. Baseline lymphopenia should not be used as exclusion criteria in early clinical trials investigating immune checkpoint blockers (PD-1/PD-L1 inhibitors). Eur J Cancer 2017; 84: 202–11.
[16] Thorsson V, Gibbs DL, Brown SD, et al. The immune landscape of cancer. Immunity 2018; 48: 812–30
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发