预测PD-1 / PD-L1抑制剂功效的Biomarkers(一)
| 导读 | PD-L1是不是优秀的预测免疫治疗疗效的Biomarker? |
01
—
肿瘤微环境相关的Biomarkers
PD-L1是不是优秀的预测免疫治疗疗效的Biomarker
通常认为,PD-L1高表达能提高免疫治疗的治疗反应率与临床获益。在Keynote052研究中,尿路上皮癌患者接受Keytruda治疗,PD-L1在1%-10%的表达范围内,随着PD-L1表达的增高,药物的疗效也相应的越来越好,PD-L1表达高于10%患者的ORR要显著高于PD-L1表达低于1%患者的ORR(39% VS 11%)。但是Checkmate032研究的结果推翻了这个结论,其研究结果显示,PD-L1高表达(>1%)的尿路上皮癌患者与低表达(<1%)的患者接受Opdivo治疗的疗效并无显著差别(24% VS 26.2%)。
研究者提出了很多假设来解释这种互斥结果:
首先,不同的临床实验采用的Cut-off值和评分标准不一致,并且每个实验中实验的IHC抗体及检测平台不一致也会导致不同的结果;
再者,PD-L1表达的上调可由很多原因引起,胞内致癌因素的变化,如PTEN缺失,接触肿瘤浸润淋巴细胞(TIL)派生的细胞因子都会引起PD-L1表达的上调,但是只有免疫力依赖的PD-L1表达的上调才能加强杀死肿瘤细胞的能力;
最后,PD-L1的表达存在患者内异质性甚至肿瘤内异质性,这种异质性会导致活检组织和手术切除组织的PD-L1表达不一致[1];并且随着治疗的进行和病情的进展,PD-L1的表达都会都相对应的动态变化,Kelly RJ et al. 发现50%晚期食管腺癌患者接受放化疗以后由PD-L1阴性表达转换成阳性表达[2]。
所以,如果将PD-L1的表达作为预测疗效的Biomarker,需要统一判读标准并考虑各种影响因素。
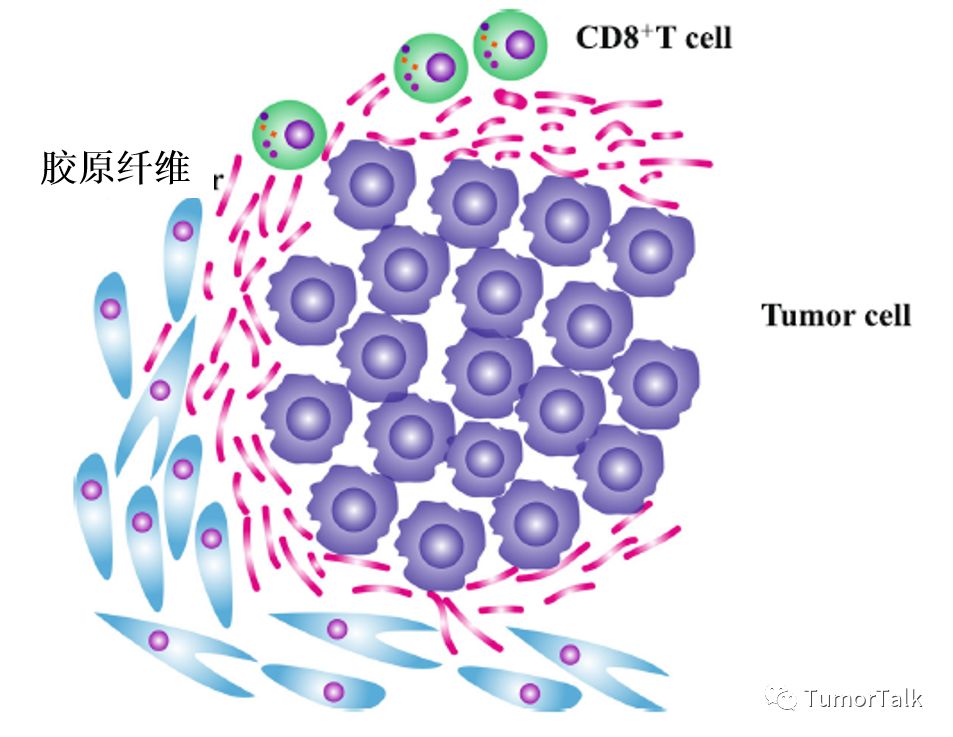
TIL(肿瘤浸润淋巴细胞)研究证实TIL的密度与PD-L1的上调及临床获益有关,PD-1/PD-L1抑制剂能够释放本来存在的TIL,从而有助于肿瘤消退。Teng MW等建立了包括TIL(存在或缺失)和PD-L1(阳性或阴性)的肿瘤免疫微环境模型[3]来预测免疫疗法的功效,发现Type I (PD-L1+TIL+)最有可能从 PD-1/PD-L1抑制剂中获益。CD8+TIL被认为是杀死肿瘤细胞并维持免疫监督的重要角色,研究显示高密度的CD8+TIL与OS的延长有显著相关性。但瘤旁纤维母细胞中TGF-β信号通路的激活能够诱导产生胶原纤维,胶原纤维包围住肿瘤细胞,从而阻止CD8+TIL渗透到肿瘤床发挥杀死肿瘤细胞的作用。因此TGF-β信号通路抑制剂与 PD-1/PD-L1抑制剂的联合使用对于免疫微环境的转变(免疫豁免型转变成免疫炎症性)有很大的优势。
TIL衍生的干扰素-γ (IFN-γ)
IFN-γ信号通路对于免疫监视是一个双刃剑,一方面,CD8+T细胞通过分泌IFN-γ抑制肿瘤细胞增殖,加强免疫活性;另一方面,TIL衍生的IFN-γ使肿瘤细胞表面的PD-L1上调,从而保护肿瘤细胞免于免疫系统的监视。不过,IFN-γ表达通常被认为是进行免疫疗法具有有利微环境的预测因子。研究显示,IFN-γ下游信号通路的缺失与免疫治疗期间的耐药有关,但是,封锁PD-1/PD-L1后,持续接触IFN-γ会导致生存选择压力,因此,完整的IFN-γ信号通路是具有强大的抗肿瘤反应的必要非充分条件。
02
—
与肿瘤固有特征相关的Biomarkers
TMB
研究显示:TMB高的患者,免疫治疗效果好。
dMMR与MSI-H
dMMR或MSI-H导致突变的积累,可以产生新抗原,而体细胞突变所产生的新抗原可作为抗肿瘤继发免疫反应的首要驱动因素。也就是说,dMMR或MSI-H能够从PD-1/PD-L1中获益。临床研究也显示,在53个晚期结直肠癌患者中,有错配修复缺陷 (dMMR) 的患者的客观反应率是50%,而没有错配修复缺陷 (pMMR) 的患者为0%,dMMR 患者的PFS 和OS 也更长,反应也更持久。2017年,抗PD-1单抗pembrolizumab和nivolumab相继获批用于dMMR/MSI-H的转移性结直肠癌(mCRC)患者。当然,dMMR或MSI-H能够增强治疗作用是归因于TIL密度的增加,提高的TMB水平,PD-L1的高表达以及更强的肿瘤特异性免疫反应。
03
—
致癌驱动突变和其他突变
EGFR突变患者接受PD-1/PD-L1治疗的疗效要差于EGFR野生型患者,因为EGFR突变能够使PD-L1上调,并阻碍TIL的活性,并且EGFR突变与低的TMB及弱的肿瘤特异性免疫反应相关。与EGFR相反,KRAS突变更易从PD-1/PD-L1抑制剂中获益,且KRAS与TP53共突变伴随有TMB高表达。ALK融合阳性与低密度的CD8+TIL和PD-L1的下调有关。其他基因,像Kataegis和APOBEC3 过表达参与PD-L1表达的调控,POLD1和POLE变异体导致影响肿瘤免疫原性的高频率的体细胞突变。
参考文献:
Biomarkers for predicting efficacy of PD-1/PD-L1 inhibitors
1, PD-L1 expression heterogeneity in non-small cell lung Cancer: defining criteria for harmonization between biopsy specimens and whole sections.
2,The dynamic and transient immune microenvironment in locally advanced
esophageal adenocarcinoma post Chemoradiation.
3,Classifying cancers based on T-cell infiltration and PD-L1.
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发