你的基因里,写着祖父母过去的经历
| 导读 |
19 世纪,“遗传”首次被作为一个科学问题提了出来,达尔文(Charles Darwin)们想要知道:一代人传给下一代的到底是什么。20 世纪初,基因第一次进入研究人员的视野,现有的生命如何与他们的祖先产生联系?基因给了他们答案。 |
19 世纪,“遗传”首次被作为一个科学问题提了出来,达尔文(Charles Darwin)们想要知道:一代人传给下一代的到底是什么。20 世纪初,基因第一次进入研究人员的视野,现有的生命如何与他们的祖先产生联系?基因给了他们答案。
这种遗传学的理论显然与让-巴蒂斯特·拉马克(Jean-Baptiste Lamarck)的观点相冲突。在达尔文之前,拉马克一直是研究生物进化和遗传的权威,他提出的理论认为获得性特征(acquired characteristics)是可以传递给下一代的。
即使 20 世纪的科学发展让这位权威的观点持续失宠,一些科学家仍然努力着,为多样的遗传形式争取存在的机会。“如果我们简单地将遗传重新定义为基因遗传,那么我们将永远不会去寻找其他的遗传方式。”
曙光仍在
20 世纪末,获得性遗传盼来了几丝希望的曙光。
1984 年,瑞典营养学家拉斯·奥雷·拜格伦(Lars Olov Bygren)发起了一项关于奥佛卡利克斯(Överkalix)人的研究。奥夫卡利克斯是瑞典的一个偏远地区,几个世纪以来,那里的人们在卡利克斯河(Kalix River)沿岸艰难地维持着生活:每隔几年,他们就会遭受毁灭性的作物欠收,长达六个月的冬季他们几乎没有食物;其他风调雨顺的年份里,好天气则给他们带来大丰收。
这样剧烈的变化对当地人产生怎样的长期影响呢?拜格伦挑选了 94 名男性作为研究对象,他绘制了他们的家谱,发现这些人的健康状况和他们祖父经历的关联:祖父在童年时代经历过饥荒的人要比那些祖父生活在丰收季的人活得长。
拜格伦还发现,这种经历在女性间也有代代相传的影响:如果一位女性的祖母出生在一场饥荒中或恰好在饥荒后,她死于心脏病的风险就会增大。众所周知,女性孕期的健康状况可能会影响胎儿,但这一发现说明,这种影响可能会进一步延伸,影响到孙辈甚至更远的后代。
关于这一点,动物实验也产生了相似的结果。21 世纪初,华盛顿州立大学(Washington State University)的生物学家迈克尔·斯金纳(Michael Skinner)团队在研究能够杀灭真菌的化学物质时,偶然发现了一种名为“乙烯菌核利”( vinclozolin)的物质,将它注射给怀孕的小鼠,它们的子代甚至再下一代都会出现精子畸形以及其他类型的性异常。
受斯金纳研究的启发,更多的人开始寻找其他可遗传的性状改变。埃默里大学(Emory University)的博士后研究员布莱恩·迪亚斯(Brian Dias)甚至对小鼠能否将记忆代代相传产生了兴趣。他开始每天都把年轻的雄性小鼠关在一个“小房间”内,定期往里面喷洒带有杏仁味的苯乙酮(acetophenone)。研究人员让小鼠闻上 10 秒钟,同时用轻微的电流刺激它们的脚。
这种每天 5 次为期 3 天的训练,足以让小鼠把这种杏仁味和电击联系起来,受过训的小鼠在闻到苯乙酮时,往往会条件反射似地杵在原地。迪亚斯还发现,苯乙酮的气味让小鼠更容易受到巨大声响的惊扰。训练结束 10 天后,埃默里大学动物资源部的研究人员从受过训练的小鼠身上收集精子,注射到同类的卵细胞中,然后将其植入雌鼠体内。
图片来源:vecteezy.com
由这些受精卵发育成的幼崽长大之后,迪亚斯也在它们身上做了行为学测试。和父辈一样,新一代的小鼠对苯乙酮很敏感,即使没有接受过联想训练,在闻过苯乙酮后它们也更容易被巨大声响吓到。研究还发现,这些小鼠的后代,也就是受训雄性小鼠的孙代,也对苯乙酮很敏感。
为了找到这种遗传关联的实质生理证据,迪亚斯检查了这些小鼠的神经系统。过去的研究表明,当受训小鼠害怕苯乙酮的时候,大脑前部特定脑区的活跃度会变大,而受训小鼠的后代大脑内也观察到了同样的变化。受到惊吓的父辈与它们后代唯一的联系就是它们的精子。这些生殖细胞向后代传递的不仅仅是基因,同样也有通过经验获得的信息。其中缘由仍是未解之谜。
正邪兼具的表观基因组
为了解释这种古怪的遗传现象,一些科学家将目光投向了表观基因组(epigenome)。表观基因组是包绕在我们的基因之上、修饰并控制它们表达的一组分子。我们的细胞不断激活独特的基因组合,来协助形成肌肉、皮肤或身体的其他部分;在细胞多次的分裂过程中,这些模式可以持续很长一段时间,这也是为什么心脏会由小发育到大,而不是转变成肾脏。
图片来源:Ahmed Yosri
而在胚胎发育的过程中,表观基因组不只严格执行基因表达的开启和终止,它对外界环境的变化也相当敏感。
它每天都会驱动身体内的生物循环:白天激活某些基因,夜间再终止它们的表达。它也可以改变基因的运作方式,以应对不可预测的信号:受到感染时,免疫细胞会重新整合自己的 DNA 表达,进入对抗病原体的战斗模式,让某些基因开始制造蛋白质,同时沉默不必要的基因;免疫细胞增殖时,这种对抗病原体状态下的表观基因组会作为一种细胞记忆传给它们的子细胞。
我们大脑中储存的记忆之所以持续存在,或许也与表观基因组发生的改变有关。20 世纪中叶,神经科学家发现新记忆形成时大脑神经元之间会构建起连接;最近,研究发现新记忆的形成会伴随一些表观遗传上的改变。例如,神经元中的 DNA 双螺旋会被重新排列、新的甲基化模式会被确定。这些持久的变化让储存长期记忆的神经元继续制造蛋白质,以保持神经元之间的连接强度。
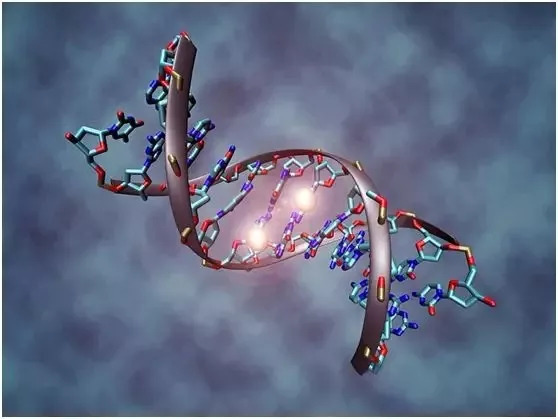
甲基化的DNA分子:两个白色球体代表甲基,它们与DNA序列的两个胞嘧啶核苷酸分子结合。
图片来源:Christoph Bock, Max Planck Institute for Informatics
然而,表观基因组的可塑性并不只会带来好处。一些研究表明,压力和其他负面影响同样可以改变我们细胞内的表观遗传模式,带来长期损害。
麦吉尔大学(McGill University)的迈克尔·米内(Michael Meaney)实验室为这一论点提供了最有力的证据。20 世纪 90 年代,米内团队开始研究大鼠的应激机制。把大鼠放进一个狭小的塑料盒中,大鼠就会焦虑,并释放激素使得脉搏跳动加快。并且,幼年时较少受到母鼠舔舐的大鼠会产生更多应激激素。
遗传学家摩西·斯齐夫(Moshe Szyf)也参与了研究,他们仔细检查了小鼠的海马体神经元(海马体是已知的参与哺乳动物应激控制的大脑区域),观察了神经元 DNA 的甲基化过程。与受到较少舔舐的大鼠相比,被母鼠舔得更多的大鼠应激激素受体基因周围的甲基化程度要低很多。
米内和斯齐夫认为,幼鼠被母鼠舔舐的体验会改变海马体中的神经元:它们的应激激素受体基因周围的一些甲基化位点被阻断,基因因此变得更活跃,也会产生更多受体蛋白。被充分舔舐的幼鼠中,这些神经元对压力更敏感,能更有效地控制它,更不易感到焦虑。
图片来源:Paul Kenyon
考虑到人类和啮齿类同属哺乳动物,人类儿童也可能在成长过程中经历长期的焦虑波动。在一项颇具争议性的小型研究中,米内和他的同事检测了人类尸体的脑组织。他们选了 12 名自然死亡、12 名自杀还有 12 名因儿时受虐而自杀的人。
他们发现,跟之前实验中较少得到母亲舔舐的幼鼠一样,儿时受虐之人的大脑内,应激激素受体基因甲基化程度更高,神经元拥有的应激激素受体的数量也更少。由此可以看出,虐待改变了孩子的表观遗传特性,影响了TA成年后的情绪控制能力,这种负面效应如滚雪球般,最终引发自杀倾向。
仍待考验
遗传学家史蒂夫·霍尓瓦(Steve Horvath)在 2011 年提出了一种想法:我们的表观基因组以稳定的速度在变化。他和同事收集了 68 人的唾液,分离出了从口腔脱落下来的细胞。他们发现,同龄人的 DNA 中有 2 个位点的甲基化模式是相同的。观察其他种类的细胞时,他们又发现,随着年龄的增长,甲基化的变化更趋稳定。到 2012 年,霍尓瓦已经能观察 9 种不同细胞 DNA 中 16 个位点的甲基化了,这些模式能以 96% 的准确率来预测人的年龄。
然而“表观遗传时钟”(epigenetic clock)的重要性仍是个未知数:消极经历如何引发表观遗传变化尚无定论;研究的规模往往很小,实验结果的可重复性也很差;甚至有可能,科学家被表观遗传变异的方式误导了,这让他们在什么都没发生的地方看到了所谓的变化。或许,“表观遗传时钟”并不是因细胞改变其表观遗传标记产生的;又或许,随着年龄的增长,某些类型的细胞会变得越来越普遍,而与年轻时更常见的细胞相比,这些细胞的表观遗传标记不尽相同。
然而,通过破解表观遗传编码,研究人员可能会发现先天与后天的联系。如果这段编码能被重写,我们就可以通过改变基因运作的方式来治疗疾病。在我们的生活中,表观遗传学所起的作用仍然存在争议;但在后代中开辟出一条遗传通道,它的可能作用仍然是非常巨大的。
许多关于人类和小鼠的研究规模都太小了,代与代之间的表观遗传相似性也可能是统计学上的错误。从分子水平上,很难看出父母的经历是如何准确地标记后代基因的,细胞中 DNA 的甲基化模式的确会改变,但尚不清楚这些变化是否可以遗传。
在受精过程中,精子的表观基因组会受到相应蛋白质的攻击。随着胚胎的成长,胚胎细胞清除了 DNA 上余留的大部分甲基化修饰,并形成新的表观基因组。这使胚胎中的细胞呈现新的面貌。胚胎发育到大约三周时,一小部分细胞就会接收到一组信号,告知它们是被永生选中的细胞,会以卵子或精子的形式存在。这些细胞的表观基因组会再次改变,DNA 中大部分甲基化修饰会被再次清除。
许多科学家怀疑:每次清除和重置后,被遗传的表观遗传标记真的能在存活下来吗?如果将遗传看作一种记忆,甲基化修饰在每一代中都会遭遇最无情最彻底的遗忘。
随着对表观遗传的关注日益增多,初期的假设被逐一推翻。例如,2015 年英国维康研究所(Wellcome Institute)的生物学家阿齐姆·苏拉尼(Azim Surani)领导了人类胚胎细胞表观遗传学的首批研究之一。他们发现原生殖细胞(primordial germ cells)虽然在转化为卵子或精子过程中会清除掉大部分原有甲基化修饰,但仍有百分之几的甲基化顽固地驻留在 DNA 上。顽固甲基化位点附近的一些基因与多种疾病有关,比如肥胖、多发性硬化症甚至精神分裂症。他们认为,这些基因是跨代表观遗传的潜在候选基因。
科学家们也开始将注意力转向其他能控制基因的分子,比如 RNA 分子。马里兰大学(University of Maryland)的生物学家安东尼·乔斯(Antony Jose)追踪了秀丽隐杆线虫(caenorhabditis elegans)体内产生的 RNA 分子,发现其大脑中产生的 RNA 分子最终会进入精子,并在那里沉默一个基因。其他研究则发现,线虫体内的 RNA 分子可以沉默之后几代线虫体内的相同基因。通过刺激幼虫复制自己,这样的 RNA 分子得以世代维持。
大量实验也已证明,人类细胞间也可以定期相互传递 RNA 分子。通常情况下,它们通过小囊泡进行传递。2014 年,意大利生物学家克里斯蒂娜·科塞斯蒂(Cristina Cossetti)观察到,雄性小鼠身上癌细胞发出的小囊泡能将 RNA 传递到精细胞中。虽然这些研究都不能证明 RNA 能够维持表观遗传,但确实让这个想法变得有趣起来。
即使体细胞与原始生殖细胞甚至后代有一定的联系,也不足以支撑拉马克的理论。19 世纪拉马克的理论之所以如此吸引人,是因为他认为后天获得的特征具有适应性,能使物种适应它们的环境。在拉马克的世界里,长颈鹿为了吃到更高处的食物伸长脖子,从而长出了更长的脖子。
在那些笃信获得性遗传的人们眼里,“遗传,只不过是过去所有环境影响的总和。”
参考资料:
https://www.theatlantic.com/science/archive/2018/06/mothers-laugh-excerpt/562478/(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发