尿路上皮肿瘤EMT和基质相关的基因表达抵抗PD-1阻断治疗
| 导读 | 在T细胞浸润的尿路上皮肿瘤中,基质细胞来源的EMT相关基因高表达与PD-1抑制剂较低的治疗响应及较差的治疗效果相关,同时靶向PD-1和肿瘤基质可为肿瘤的治疗带来新的思路和策略。 |
原文出处
Wang L, Saci A, Szabo PM, Chasalow SD, Castillo-Martin M, Domingo-Domenech J, Siefker-Radtke A, Sharma P, Sfakianos JP, Gong Y, Dominguez-Andres A, Oh WK, Mulholland D, Azrilevich A, Hu L, Cordon-Cardo C, Salmon H, Bhardwaj N, Zhu J, Galsky MD. EMT- and stroma-related gene expression and resistance to PD-1 blockade in urothelial cancer. Nat Commun. 2018 Aug 29; 9(1):3503.
研究背景
尿路上皮癌是世界范围内常见的恶性肿瘤,也是我国泌尿外科临床最为常见的恶性肿瘤之一。近十余年来,晚期尿路上皮癌的治疗尚无重大突破,随着PD-1/PD-L1抑制剂的获批上市,晚期/转移性的尿路上皮癌患者的治疗有了更多的选择。大约15-25%的顺铂耐药的转移性尿路上皮癌患者可从PD-1/PD-L1抑制剂治疗中获得持久的临床疗效,然而大部分患者无法从中获益。因而,了解患者对PD-1/PD-L1抑制剂原发耐药的机制是十分重要的。T细胞浸润的癌症往往对PD-1/PD-L1阻断治疗具有更高的效应率,然而,Wang等的研究表明,T细胞浸润的尿路上皮肿瘤患者中,来源于非造血基质细胞的EMT相关基因的表达水平与T细胞浸润丰度(ITA)正相关,与EMT相关基因低表达的CD8浸润肿瘤患者相比,该类型的肿瘤患者对PD-1抗体(nivolumab)治疗的响应率更低,无疾病进展生存期和总生存期较短。这可能是因为在该类型的肿瘤微环境中,CD8阳性细胞主要局限在基质细胞间,而被迫与肿瘤细胞分离。该研究工作表明在尿路上皮肿瘤中存在一种由基质介导的免疫抵抗机制,可为开发共同靶向PD-1和基质细胞的肿瘤治疗策略提供理论支撑和思路。研究成果于8月29日,发表在《Nature Communication》上,题为“EMT- and stroma-related gene expression and resistance to PD-1 blockade in urothelial cancer”。
研究结果
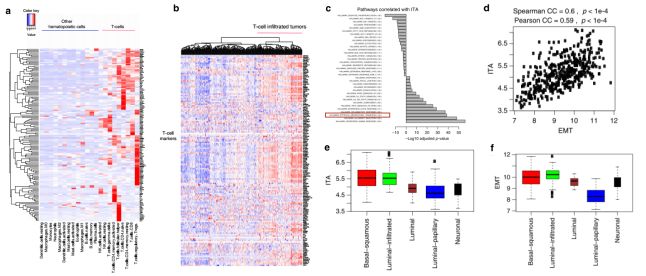
1. 尿路上皮肿瘤中上皮间质转化(EMT)相关基因的表达与T细胞浸润相关(TCGA数据库)
免疫细胞相关标志基因的表达可用于反映肿瘤中免疫细胞浸润的丰度,研究人员对22种不同类型或状态的免疫细胞中免疫相关标志基因的表达进行了分析,结果发现有144个基因在T细胞中高表达(Fig. 1a)。进而依据这144个T细胞相关标志基因在尿路上皮肿瘤中的表达,将其分为T细胞浸润肿瘤和非T细胞浸润肿瘤两种类型(Fig. 1b)。对与肿瘤T细胞浸润丰度(tumor-infiltrating T-cell abundance, ITA)存在相关性的基因和信号通路的筛选分析发现,免疫相关的信号通路(如IFN,炎症和TNF信号通路)与ITA正相关,EMT相关基因的表达也与ITA正相关(Fig. 1c, d)。一些研究表明,尿路上皮肿瘤可根据其基因表达谱进行分子分型,作者的研究发现在不同亚型的尿路上皮肿瘤中,luminal-infiltrated 和 basal-squamous 亚型中的EMT相关基因与ITA均高表达,EMT相关基因表达与ITA正相关(Fig. 1e, f)。
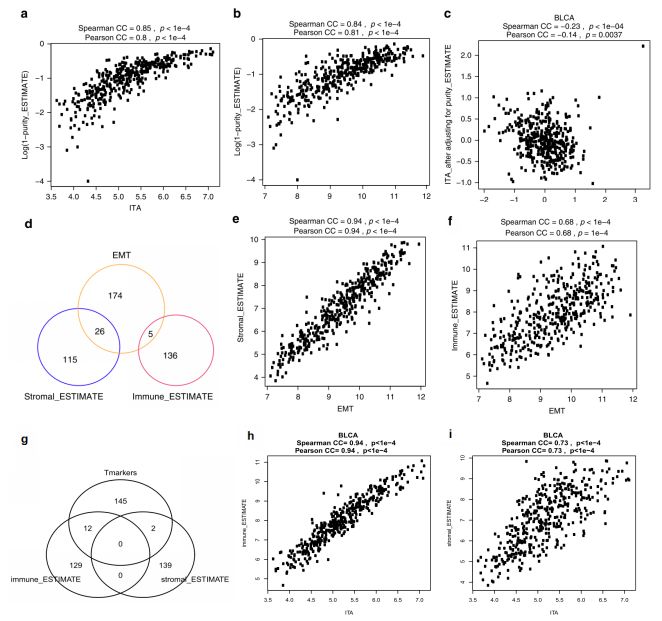
2. EMT相关基因表达与ITA间的正相关关系依赖于肿瘤的纯度(TCGA数据库)
有研究表明,在结肠癌中EMT相关基因主要由基质细胞而非肿瘤细胞表达。因而,研究人员使用ESTIMATE (Estimation of Stromal and Immune cells in Malignant Tumor tissues using Expression data) 计算工具进一步分析了EMT相关基因表达、ITA及其与肿瘤纯度间的关系。ESTIMATE通过对转录本表达的计算分析可区分出两种不同特征的基因表达谱以鉴别免疫细胞和基质细胞(即immune_ESTIMATE 和stromal_ESTIMATE),并可依据免疫细胞和基质细胞各自的组成来评估肿瘤的纯度。TCGA尿路上皮肿瘤数据资料分析显示,EMT相关基因表达及ITA均与较低的肿瘤纯度呈现明显的正相关(Fig. 2a, b)。根据肿瘤纯度调整后的EMT相关基因表达及ITA间的正相关关系丢失,即调整后的EMT相关基因表达与ITA间无明显相关性(Fig. 2c)。尽管EMT相关基因、immune_ESTIMATE基因 和stromal_ESTIMATE基因间存在小部分的重叠(Fig. 2d),相比于immune_ESTIMATE基因,EMT相关基因的表达与stromal_ESTIMATE基因间的正相关关系更为明显(Fig. 2e, f)。而与stromal_ESTIMATE基因相比,ITA则与immune_ESTIMATE基因间具有更显著的正相关(Fig. 2g, h, i)。这些结果表明,尿路上皮肿瘤中EMT相关基因的表达可能来源于基质细胞而非肿瘤细胞。
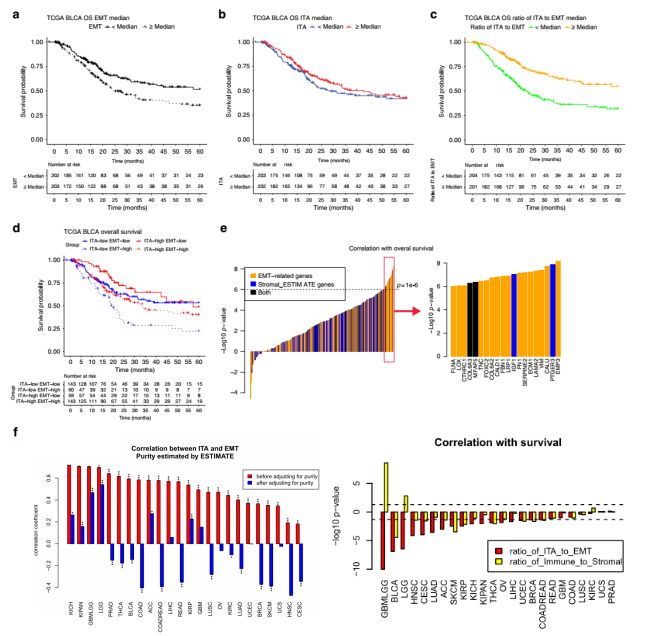
3. EMT相关基因与ITA对尿路上皮肿瘤患者的生存期具有不同的影响(TCGA数据库)
TCGA数据显示,接受膀胱切除治疗的肌层浸润性膀胱癌患者中,EMT相关基因的高表达与患者较差的总生存期相关(Fig. 3a),而ITA则与患者总生存期无明显相关性(Fig. 3b)。进一步的结果显示,ITA与EMT相关基因表达的比值与患者生存期显著相关(Fig. 3c),表明联合使用ITA和EMT相关基因可用于膀胱癌患者的预后判断。根据ITA和EMT相关基因的表达可将上述膀胱癌患者分为四种类型(ITAhigh EMTlow、ITAhigh EMThigh、ITAlow EMTlow和ITAlow EMThigh),与ITAlow EMThigh的患者相比,ITAhigh EMTlow的患者生存期更长(Fig. 3d)。
研究人员认为ITA与EMT相关基因表达联合可用于预测肿瘤患者生存期,可能是由于ITA与EMT相关基因表达反映了肿瘤微环境中免疫细胞(T细胞)与免疫抑制性的基质细胞间的平衡状态。由此,他们对其它类型的免疫细胞也进行的相似的分析,结果显示,在双变量Cox回归模型中,以EMT相关基因表达为基准进行调整后,大多数的免疫细胞类型(尤其是T细胞和NK细胞)均与较好的总生存期相关(数据未显示)。尽管EMT相关基因表达与stromal_ESTIMATE基因显著相关,但EMT相关基因表达与总生存期间的相关关系更为明显。经ITA和EMT相关基因调整后的stromal_ESTIMATE基因与总生存期无明显相关性,而经ITA和stromal_ESTIMATE基因调整后的EMT相关基因表达仍与总生存期相关(数据未显示)。将EMT相关基因和stromal_ESTIMATE基因中单个基因的表达与患者总生存期进行相关性分析发现,与患者总生存期相关性最为显著的前20个基因中有18个都是EMT相关基因(记为 EMT/Stroma_core 基因)(Fig. 3e)。同样地,在多种肿瘤类型中,ITA与EMT相关基因表达间均具有明显的相关性,经肿瘤纯度调整后,二者间的相关性明显降低,并且ITA与EMT相关基因表达的比值与患者生存期显著相关(Fig. 3f)。以上结果表明,ITA与EMT相关基因对尿路上皮肿瘤患者的生存期具有不同的影响,其比值可用于患者的预后判断,且这一预后指标并不是尿路上皮肿瘤所特有的,可能具有广谱性。
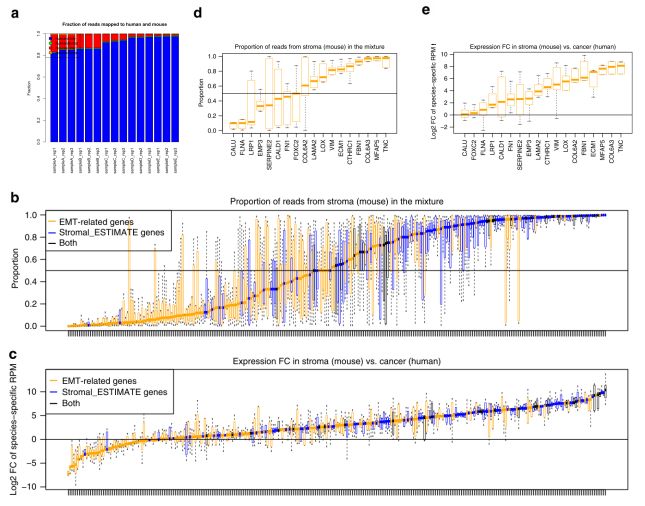
4. 在尿路上皮肿瘤PDX模型中,基质细胞是EMT相关基因的主要来源
为进一步明确EMT相关基因的来源,研究人员建立了尿路上皮肿瘤的PDX模型。在这一模型中,构成肿瘤组织的肿瘤细胞是来源于尿路上皮肿瘤患者(人)的,而基质细胞是来源于小鼠的。对5个PDX模型的尿路上皮肿瘤组织进行RNA测序分析,通过Bamcmp计算区分来源于人和小鼠的RNA序列。结果显示,中位肿瘤纯度(来源于人的RNA序列占总序列的百分比)为94%(Fig. 4a)。在单个基因的水平上,EMT相关基因来源于小鼠(基质细胞)的中位数为30%,明显高于其它的基因(Fig. 4b)。在肿瘤样本中分析基因表达来源不仅与这些序列在肿瘤细胞和基质细胞中的相对百分比相关,也与单个基因在这些细胞(肿瘤细胞或基质细胞)中的表达程度相关。对单个基因在每个小鼠和人细胞中表达(通过物种特异性的RPM来反映)的改变倍数进行log2计算,结果显示,EMT相关基因的log2 FC的中位数为2.02,明显高于其它基因(Fig. 4c)。在PDX模型中,对前述提及的18个EMT/Stroma_core 基因进行检测分析发现,其中有11个基因的表达主要来源于小鼠细胞,即与人相比,有更高比例的序列来自小鼠(Fig. 4d),其log2 FC的中位数为4.23(Fig. 4e)。总之,上述结果进一步证实,基质细胞是EMT相关基因表达的主要来源。
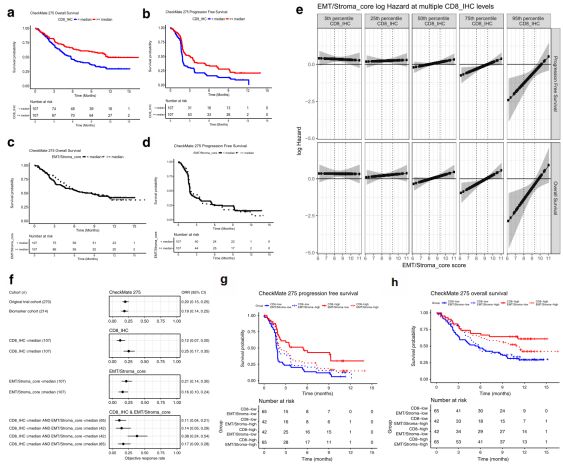
5. EMT/基质相关基因及T细胞浸润(ITA)对免疫检查点阻断治疗及患者生存的影响
PD-1抗体nivolumab的2期临床试验(CheckMate 275)表明,其在一部分的转移性尿路上皮肿瘤患者获得了持久的临床治疗效果,并被批准用于顺铂耐药的转移性尿路上皮肿瘤的治疗。在本研究中,作者利用CheckMate 275数据集分析了T细胞浸润和EMT相关基因表达对nivolumab治疗后患者响应率、无疾病进展生存期及总生存期的影响。在该项分析中,EdgeSeq平台 (HTG Molecular)和免疫组织化学染色的CD8阳性细胞计数分别用于评估EMT和ITA信号。在入选的270位患者中,分别有217位和263位患者具有可供使用的基因表达数据和CD8免疫组化数据,最终用于生物标记评估的为214位同时具有基因表达数据和CD8免疫组化数据的患者。在200种EMT相关基因中,EdgeSeq平台中概括了133种;在18个EMT/Stroma_core 基因中,EdgeSeq平台中包含了其中的8种(FLNA、EMP3、CALD1、FN1、FOXC2、LOX、FBN1和TNC)。在进一步的分析中发现,133种EMT相关基因表达及8种EMT/Stroma_core 基因表达对nivolumab治疗具有相似的影响(数据未显示)。在CheckMate 275患者群体中,CD8的表达水平与EMT/Stroma_core 基因表达水平正相关,较高水平的CD8 T细胞浸润与更高的患者响应率及更长的无疾病进展生存期和总生存期相关,而EMT/Stroma_core 基因表达水平与患者响应率、无疾病进展生存期和总生存期无明显相关性(Fig. 5a, b, c, d)。进一步的分析结果显示,EMT/Stroma_core 基因表达水平与患者响应率、无疾病进展生存期和总生存期间的相关性只在CD8高浸润的肿瘤中存在,而在CD8低浸润的肿瘤中,EMT/Stroma_core 基因表达水平与患者响应率、无疾病进展生存期和总生存期无关(Fig. 5e)。
依据肿瘤组织中CD8浸润和EMT/Stroma_core 基因表达可将患者分为四个亚群(CD8high EMT/Stromalow、CD8low EMT/Stromalow、CD8high EMT/Stromahigh、CD8low EMT/Stromahigh),如图Fig. 5f, g, h所示,CD8high EMT/Stromalow的患者群具有更高的响应率和更长的无疾病进展生存期和总生存期,而CD8high EMT/Stromahigh的患者的临床治疗效果则较差。综上所述,在CD8浸润的尿路上皮肿瘤中,EMT/Stroma相关基因表达与PD-1阻断治疗抵抗相关。
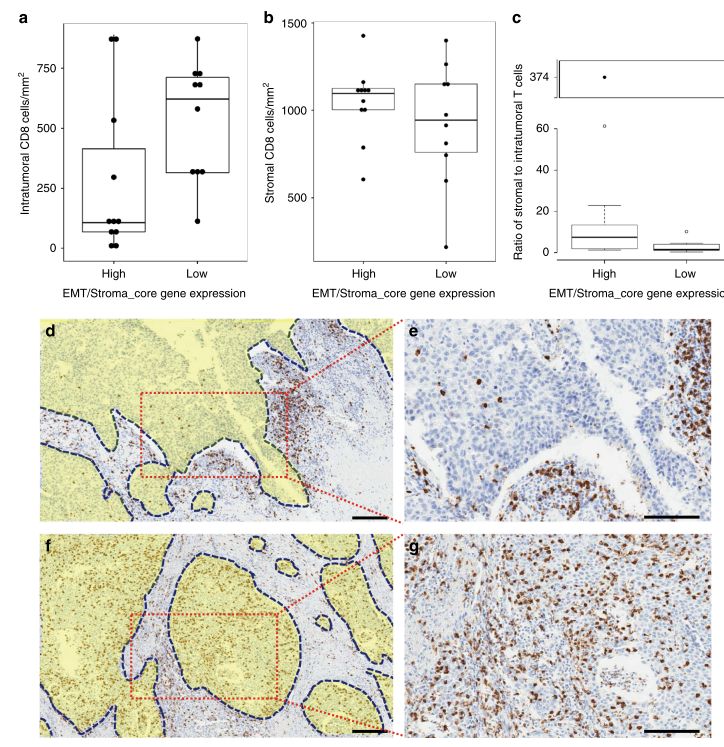
作者认为 EMT/Stroma core基因高表达的CD8浸润肿瘤可能代表了一类具有原始免疫排斥特性的肿瘤类型,在这种肿瘤中,CD8阳性细胞主要分布在基质细胞间,在空间上是与肿瘤细胞分离的。因而,研究者进一步分析对比了EMT/Stroma core基因高表达或低表达的CD8浸润肿瘤中CD8阳性细胞的定位,如Fig. 6所示,EMT/Stroma core基因高表达的肿瘤样本中,肿瘤内CD8阳性细胞明显低于EMT/Stroma core基因低表达的肿瘤,并且基质内CD8阳性细胞与肿瘤内CD8阳性细胞的比值更高。这表明,EMT/Stroma core基因高表达的CD8浸润肿瘤中,CD8阳性细胞与肿瘤细胞被基质细胞阻隔而被迫分离,这可能是其产生免疫抵抗的原因。
研究结论
在T细胞浸润的尿路上皮肿瘤中,基质细胞来源的EMT相关基因高表达与PD-1抑制剂较低的治疗响应及较差的治疗效果相关,同时靶向PD-1和肿瘤基质可为肿瘤的治疗带来新的思路和策略。
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发