新型抗肿瘤DNA疫苗问世,同时靶向7个位点!
| 导读 | 目前世界各国研究人员均在进行肿瘤特异性抗原的筛选工作,这令免疫疗法成为众多肿瘤患者的救命药物。但随着各类研究的逐渐深入,研究者发现由于较低的CD8+T细胞免疫原性、载体毒性及有限的特异性靶抗原等因素使得 抗肿瘤疫苗的研发工作进展缓慢。 |

目前世界各国研究人员均在进行肿瘤特异性抗原的筛选工作,这令免疫疗法成为众多肿瘤患者的救命药物。但随着各类研究的逐渐深入,研究者发现由于较低的CD8+T细胞免疫原性、载体毒性及有限的特异性靶抗原等因素使得 抗肿瘤疫苗的研发工作进展缓慢。
来自Wistar研究所的研究人员开发了一种全新设计的DNA抗肿瘤疫苗,其研究的最新进展发表于最新的《Clinical Cancer Research》杂志。

Wistar研究所的研究人员开发出一种具有全新结构的合成DNA疫苗,这种疫苗可同时靶向多种肿瘤中特异性过表达的靶向蛋白质。
我们都知道当前癌症免疫治疗有一个痛点——通过单一,易于使用的疫苗制剂中同时靶向多种肿瘤抗原,进而产生抗肿瘤免疫应答。
而该免疫疗法可以简化当前免疫疗法繁琐的操作步骤,并可防止肿瘤产生免疫逃逸现象。
这种靶向肿瘤相关MAGE-A蛋白家族的新DNA疫苗在黑色素瘤临床前模型中显示出较好的疗效,大大改善了黑色素患者的预后。
MAGE家族的抗癌前景良好
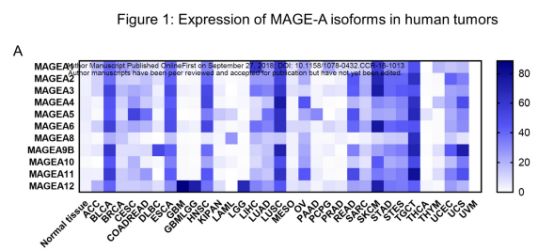
由于MAGE-A的表达仅限于肿瘤细胞,因此MAGE-A家族中的蛋白质成员代在免疫疗法中成为了希望的靶标。然而,虽然实体瘤中MAGE-A3具有十分高的表达量,但靶向MAGE-A3的抗肿瘤疫苗迄今未能在临床试验中证明有效。
为了解决这个问题并将这种有前景的免疫疗法推向临床应用,Wistar的研究人员对人类中MAGE-A家族中的12种蛋白质的表达水平进行了分析。
他们观察到在MAGE-A家族中,不仅仅MAGE-A3在多种肿瘤的肿瘤细胞中高表达,其中一些蛋白质会在同一患者出现重表达的现象。这些研究结果表明,由于天然免疫耐受的存在,先前靶向一个蛋白的疫苗可能无法有效驱动T细胞免疫的产生。

新型DNA疫苗具备多重免疫靶向位点
首席研究员David W. Weiner博士表示,“将蛋白结构设计技术和合成DNA技术相联合为研究者靶向肿瘤免疫抗原提供了充足的设计灵活性和疫苗特异性,他们合并了多个来自MAGE-A成员的一级序列,并获得了能够同时靶向七个MAGE-A家族成员的优化DNA疫苗。该疫苗能够被宿主免疫系统准确识别,进而提高肿瘤患者对肿瘤的免疫反应”。
在小鼠中测试,疫苗诱导的多种MAGE-A蛋白免疫交叉反应诱导出强劲的CD8 + T细胞介导的免疫反应。Weiner博士表示,“CD8 + T细胞是免疫治疗反应中主要的效应产物,我们可以将它们视为肿瘤免疫学中的“海豹突击队”。
重要的是,该疫苗显着减缓了黑素瘤小鼠模型中肿瘤的生长并延长黑素瘤小鼠的存活时间。研究人员发现在疫苗注射后,肿瘤的皮肤侵入降低,这与CD8 + T细胞积聚到肿瘤中相关,该现象证明了此种疫苗能够对黑色素瘤产生强有力的抗肿瘤免疫力。
参考文献:
Elizabeth K. Duperret, Shujing Liu, Megan Paik, Aspen Trautz. A designer cross-reactive DNA immunotherapeutic vaccine that targets multiple MAGE-A family
members simultaneously for cancer therapy
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发