刮骨疗毒的现实版取骨冻瘤来了!独家揭秘尤文氏肉瘤的起源!
| 导读 | 近日,一则消息在微博上疯传,上图为一位小朋友大腿的骨头,他患的是尤文氏肉瘤(一种侵袭性骨癌,主要发生在儿童,青少年和年轻人身上),医生将他的骨头取出来之后,液氮超低温杀灭癌细胞,又重新放回体内。从而保住了他的双腿,避免截肢之痛。小转不禁感慨起医疗技术的蓬勃发展,但是这种技术看似奇异,实则有迹可循。 |
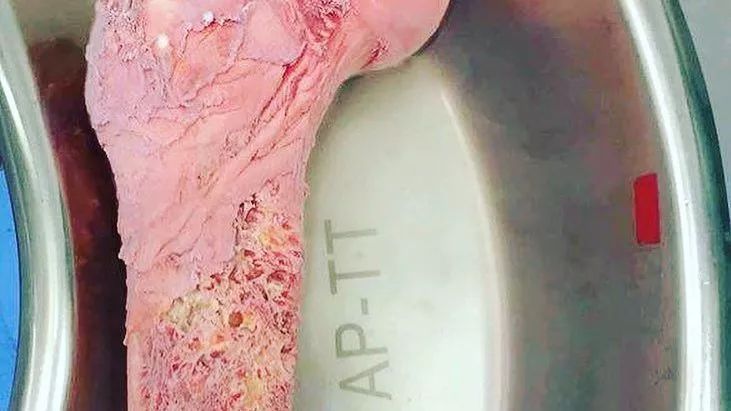
近日,一则消息在微博上疯传,上图为一位小朋友大腿的骨头,他患的是尤文氏肉瘤(一种侵袭性骨癌,主要发生在儿童,青少年和年轻人身上),医生将他的骨头取出来之后,液氮超低温杀灭癌细胞,又重新放回体内。从而保住了他的双腿,避免截肢之痛。
小转不禁感慨起医疗技术的蓬勃发展,但是这种技术看似奇异,实则有迹可循。《三国演义》中便有刮骨疗毒的记载。
刮骨疗毒

关羽曾经被乱箭所射中,贯穿了他的左臂,后来伤口虽然痊愈,(但是)每到阴雨天,骨头常常疼痛。医生说:"箭头有毒,毒已深入骨髓里,应当剖开手臂打开伤口,刮骨头除去毒素,这个隐患才可以除去。"关羽便伸出手臂让医生剖开它。当时关羽正在和诸位将领围坐在一起喝酒,手臂鲜血淋漓,都漫出盛血的盘子了,但是关羽却割肉喝酒,谈笑如常。
当然,刮骨疗毒不过只是传说。而这是实实在在的切骨去瘤。那么,尤文氏肉瘤究竟是如何发生的呢?小转就来给大家扒一扒。
原来,这种恶性肿瘤来源于基因突变,来自慕尼黑Ludwig-Maximilians-Universitaet(LMU)的研究人员在分子水平上阐明了在欧洲人群中常见的遗传突变如何与自发的体细胞突变相互作用以促进尤因氏肉瘤的发展。
肿瘤细胞单个自发的“驱动突变”会导致形成致癌融合基因EWSR1-FLI1的表征。它的蛋白质产物EWSR1-FLI1可以作为一种有效的基因激活剂,对于维持恶性肿瘤必不可少。有趣的是,一项全基因组关联研究已在三个不同的基因组位点检测到遗传性遗传变异,从而增加了对该疾病的易感性。
由ThomasGrünewald博士(LMU病理学研究所儿科肉瘤生物学实验室负责人)领导的研究小组和位于巴黎Institut Curie和Bethesda(马里兰州)国家癌症研究所的团队展开合作。研究这些种系变体之一如何与EWSR1-FLI1相互作用以促进肿瘤发生的。
综合方法可以带来回报
Grünewald和他的同事们专注于一个基因组片段,其中一个易感位点先前被绘制过。使用靶向深度测序技术,他们确定了从数百名尤文氏肉瘤患者和一组健康对照中获得的种系DNA中该区域的序列。通过分析两组之间遗传性遗传变异的分布,他们能够确定与疾病相关的变异。然后,他们使用表观遗传和功能测定来检查这些风险变异对体外和体内尤文氏肉瘤细胞生长的影响。
使用这种综合方法,研究人员发现特异性种系易感性变异,在尤因氏肉瘤患者中比在对照组中更为普遍,在使体细胞驱动突变EWSR1-FLI1(仅在肿瘤细胞中发现)中发挥重要作用。增强肿瘤发生。Grünewald指出,我们的工作提供了第一份关于体细胞驱动突变和易感种系变异之间直接和特异性遗传相互作用的正式文献。
肿瘤细胞劫持信号通路
研究小组将易感种系变异定位在一个名为EGR2的基因附近。EGR2本身是参与调节细胞增殖的转录因子,并且通过由生长因子EGF和FGF控制的信号通路激活。引人注目的是,EGR2不仅对于神经干细胞的发育至关重要,而且对于骨祖细胞的发育也是必不可少的,这表明它可以在尤因氏肉瘤中发挥积极作用。
此外,种系突变位于控制EGR2表达的调控元件中,随后的实验揭示了为什么这种突变与驱动突变EWSR1-FLI1的组合促进尤文氏肉瘤的肿瘤发生。这些分析表明,易感突变产生了高亲和力位点,用于将EWSR1-FLI1与EGR2调节元件结合。这反过来导致EGR2的高水平激活,这可能重启胚胎干细胞增殖计划。遗传调节突变和致癌基因融合之间的这种相互作用解释了为什么前者会增加尤因氏肉瘤的风险,并可能加剧这种疾病。
研究者表示:“这些发现也有助于解释为什么欧洲血统的人发展尤因氏肉瘤的风险更高。借助于1000个基因组计划(现已对几千个人的基因组进行测序)获得的数据,这项新研究的作者还研究了易感变异在不同人群中的分布。'大约80%的欧洲人在其种系DNA中携带至少一个变异等位基因拷贝,而这种突变在非洲人群中非常罕见。然而,只有当产生EWSR1-FLI1融合基因的驱动突变在体细胞中自发产生时,该等位基因才是有害的。不过这种联络危险非常罕见。”
他们已经在寻找将新结果转化为有效治疗疾病的方法。在细胞培养物和小鼠模型系统中显示,阻断由EGR2激活的遗传程序足以阻止肿瘤生长。
在小编看来,取骨冻瘤的技术好处在于,不必刮骨疗毒,壮士断腕。患者可以免受截肢之苦,不是简单的拯救生命,而是拯救了一个孩子的一生,期待医学能给我们带来更多的惊喜!
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发