Nature:CRISPR编辑技术存在致癌风险,全球首例基因编辑婴儿的未来谁来负责?
| 导读 | 昨天,你应该被基因编辑婴儿的新闻刷屏了吧,(转基因人类问世!是人类新时代还是潘多拉魔盒已经打开?)小编也是,微信群里大家议论纷纷。从投票来看,大部分票数都投向了反对。反对声音集中在了技术存在的未知风险和伦理争议上。各国科学家纷纷谴责其违背了医学伦理,现卫计委等多方已经介入整个实验的调查当中。 |
昨天,你应该被基因编辑婴儿的新闻刷屏了吧,(转基因人类问世!是人类新时代还是潘多拉魔盒已经打开?)小编也是,微信群里大家议论纷纷。从投票来看,大部分票数都投向了反对。
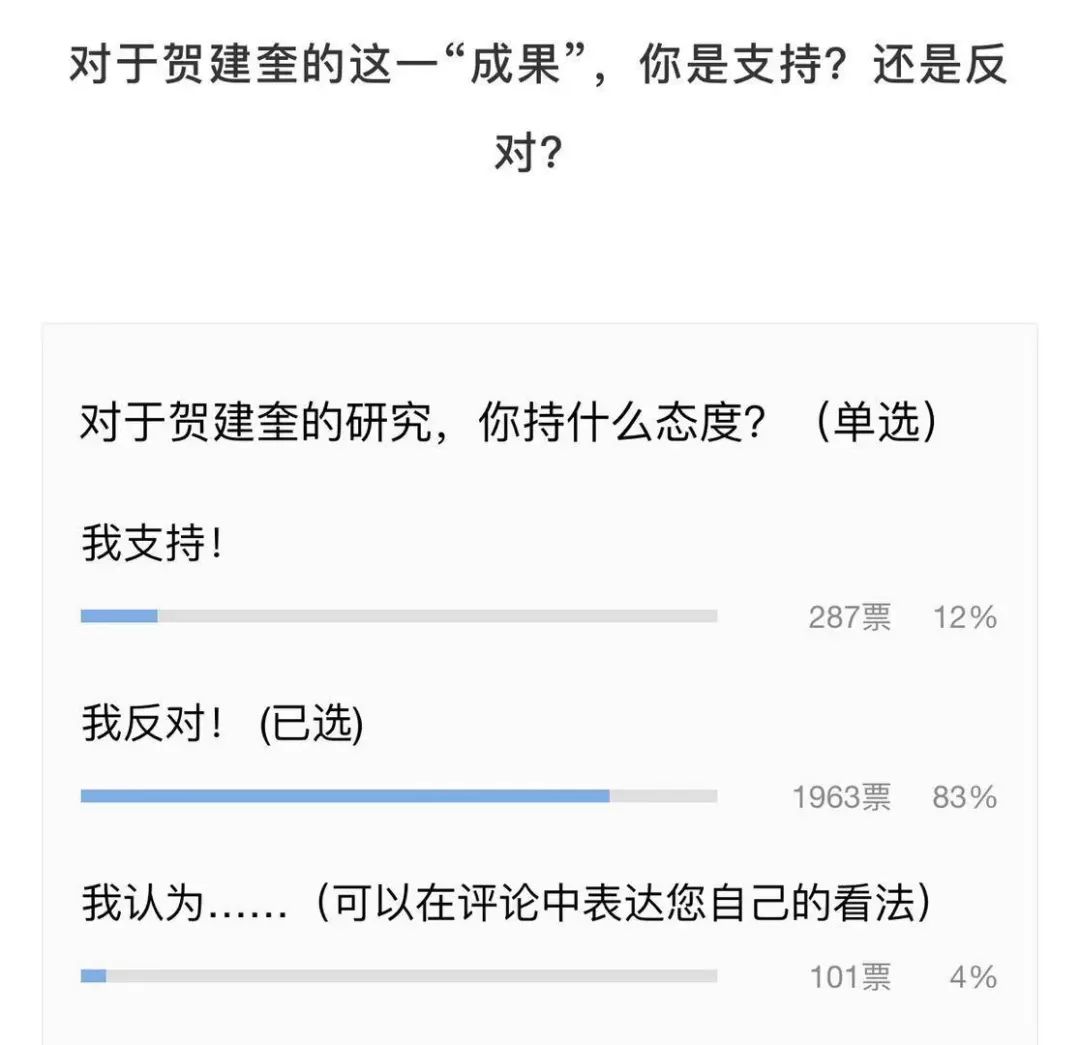
反对声音集中在了技术存在的未知风险和伦理争议上。各国科学家纷纷谴责其违背了医学伦理,现卫计委等多方已经介入整个实验的调查当中。
今天,伦理的事先不谈,小编想和大家聊聊关于CRISPR-Cas9技术,这位“新晋网红”的那些事。
通过找到突变位点,通过CRISPR-Cas9基因编辑技术,将致病基因切除根治疾病是科学家的初衷。
初衷是好的,但是和很多新技术一样,它也是一把双刃剑,存在诸多的隐患。小编认为在这些隐患还没有得到根本性的解决之前,贸然进行人体临床实验是对项目参与者的不负责任。

从技术层面上来看,CRISPR-Cas9基因编辑技术脱靶效应就一直存在着争议,也就是说在编辑目的基因时可能会对其它不期望编辑的位点也进行编辑。
《Nature biotechnology》上的研究报告称,利用CRISPR编辑老鼠胚胎干细胞、造血干细胞和人类分化的细胞系时靶标位点也存在明显的突变,包括大片段的删除以及复杂的基因组重组,而这些突变可能致病。
《Nature》也在前不久前发布过的两篇报道,声称CRISPR编辑技术存在致癌风险。


这两篇文章中均有提到的明星分子—P53。肿瘤蛋白p53,简称为p53,其在各种哺乳动物体内具有高度保守性且存在众多同源分子,如TP53(人)和Trp53(小鼠)。
这些同源分子在多细胞生物体内至关重要,其中它最为关键的作用是抑制肿瘤的产生,是肿瘤抑癌基因中最为出名的一个。因此,p53被称为“基因组的守护者”,它通过阻止基因组发生突变,维持基因稳定而阻止肿瘤的发生。
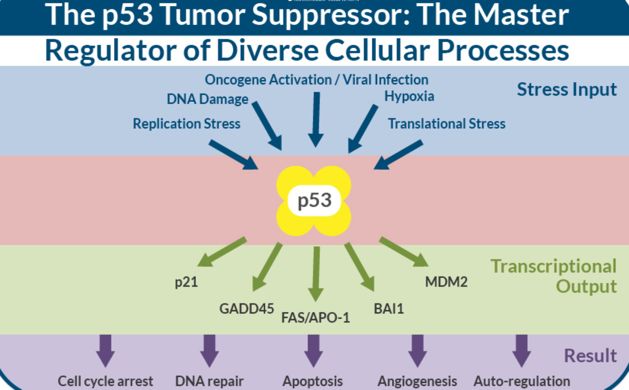

来自Karolinska研究所Jenna Persson及其研究团队发现CRISPR-Cas9基因编辑引发由p53介导的DNA损伤反应和人视网膜色素上皮细胞中出现的细胞周期停滞,导致由功能性p53参与的基因校正出现异常。
研究人员在对p53基因敲除的细胞与野生型p53基因细胞均进行CRISPR基因编辑后进行了详细的分析,他们发现抑制DNA损伤信号可以提高CRISPR基因编辑的编辑效率,但抑制p53且导致细胞更容易出现染色体重排和其他致瘤突变。
因此研究者得出结论,正常细胞中瞬时抑制p53的功能对CRISPR编辑细胞由正面和负面双重作用。一方面,抑制p53可导致存有致瘤基因的细胞发生逃逸现象。另一方面,抑制p53会CRISPR提高编辑效率并降低p53缺导致的选择优势。
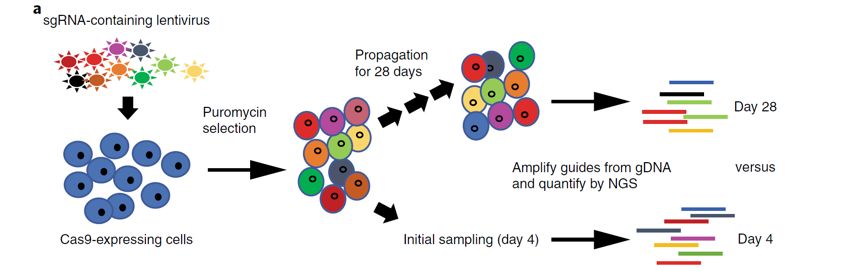
CRISPR / Cas9已经彻底改变了人类设计基因组和在人体细胞中进行全基因组筛选的能力。尽管一些细胞类型适合进行基于基因组的相关工程,但人类多能干细胞(hPSC)的基因组很难被设计改造,这是由于hPSC相对于肿瘤细胞系或小鼠胚胎干细胞其基因编辑效率较低。
来自诺华研究所Zinger Yang教授及其研究团队使用具有Cas9-核糖核蛋白(RNP)瞬时递送的hPSC系,实现了大于80%的平均插入或缺失(indel)效率。这一结果的产生揭示了Cas9诱导的双链断裂(DSBs)存在十分巨大的细胞毒性且杀死了大多数hPSC细胞。
在先前的研究中,研究者发现p53基因的突变对产生双重作用,在提高基因编辑效率的同时,且导致致瘤细胞逃逸使“错配”细胞的致癌率大大增加。虽然P53的突变率在其他临床相关的细胞类型中仍有待明确,但在hPSCs中p53 存在明显的突变,这是在hPSCs中应用基因编辑一个巨大障碍。这也提示研究者在设计编辑细胞之前,必须充分评估风险和益处,确定工程细胞中P53的自发突变率以及与瞬时抑制P53带来的突变负荷。
虽然现在全基因组分析技术日益完善,但这并不意味着可以利用这一技术知晓人体所有遗传信息的变化情况。所以,在进行人体,甚至胚胎实验时,科学家们应全面评估研究风险。
参考文献
1.Tripti Kulkarni,Zinger Yang ,Gregory McAllister. p53 inhibits CRISPR–Cas9 engineering in human pluripotent stem cells
2.Jenna Persson , Bernhard Schmierer. CRISPR–Cas9 genome editing induces a p53-
mediated DNA damage response
3.科学大院:登上Science专刊的CRISPR技术究竟是啥?
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录
还没有人评论,赶快抢个沙发